Ароматические амины находят применение при синтезе красителей, лекарственных препаратов сульфаниламидного ряда, а также резин, пенопластов и других продуктов химической, фармацевтической и текстильной промышленности. Ввиду этого актуальна задача очистки сточных вод промышленных предприятий от загрязнений ароматическими аминами. В настоящее время одним из наиболее эффективных физико-химических методов очистки сточных вод от органических соединений является адсорбция с применением экономически рентабельных и высокоэффективных адсорбентов на основе природных алюмосиликатов, модифицированных добавками поверхностно-активных соединений. Авторами [1, c. 143] показано, что адсорбция катионоактивных красителей метиленового голубого и родамина-J на гидрофобизированном бентоните выше, чем на чистом, что связано с увеличением межплоскостных расстояний и проникновению из модельных растворов. В [2, c. 222] показано, что адсорбция катионного адсорбтива на модифицированном бентоните удовлетворительно характеризуется изотермой Ленгмюра. Модификация алюмосиликатов монтмориллонитового типа катионным поверхностно-активным веществом приводит к формированию слоев модификатора, распределенных в межслойных пространствах, а также на поверхности адсорбента [3, с. 266], что повышает их адсорбционную активность в отношении катионных красителей. Авторами [4, с. 77] показано, что эффективность взаимодействия ПАВ с бентонитом и конформация их молекул в межслоевом пространстве алюмосиликата зависят от присутствия ионов кальция. Внедрение молекул катионных поверхностно-активных веществ в структуру бентонита приводит к возрастанию его адсорбционной активности по отношению к имидаклоприду, при этом кинетика адсорбции описывается константой скорости псевдопервого порядка для немодифицированного адсорбента и псевдовторого порядка для модифицированного адсорбента, механизм адсорбции описывается изотермой Фрейндлиха [5, с. 327]. Отмечается [6, с. 1278], что адсорбция метиленового голубого из водного раствора с помощью органобентонита описывается изотермами Ленгмюра и Чепмена, при этом степень извлечения возрастает в присутствии альгината кальция. Применение катионных ПАВ, в частности бромида гексадецитриметиламмония в качестве модификатора бентонита приводит к возрастанию эффективности извлечения анионных красителей из воды [7, c. 1758]. Авторами [8, c. 567; 9, с. 82] установлено, что извлечение красителя кислотного красного и кислотного зеленого из водного раствора с помощью бентонита, модифицированного катионными ПАВ, увеличивается при понижении кислотности среды, описывается изотермами Ленгмюра и Фрейндлиха и характеризуется кинетическим уравнением второго порядка. Известен подход [10, c. 855] физико-химической ремедиации природных водоемов, загрязненных фенолами, основанный на поочередном внесении бентонита, а затем небольшого количества катионного поверхностно-активного вещества, которые в ходе флокуляции образуют органобентонит. Значительная роль в адсорбции на глинистых материалах принадлежит структурному фактору. При формировании системы «алюмосиликат – поверхностно-активное вещество» с увеличением степени интеркалирования модификатора в структуру адсорбента упаковка его алкильных цепочек отвечает переходу от монослойного к би-
слойному и трислойному фрагментам, кроме того, увеличение длины алкильной цепи в молекуле поверхностно-активного вещества способствует повышению эффективности адсорбции органических соединений из воды [11, c. 13302]. В [12, с. 116] получена математическая модель взаимосвязи структурных характеристик адсорбента, модификатора и адсорбата с адсорбционной активностью модифицированных алюмосиликатных систем.
Цель исследования – установить вид изотермы адсорбции и ее характеристик для процесса удаления о-толуидина из сточных вод с помощью бентонита, модифицированного глицерином и углеродными нанотрубками в статических условиях. Для достижения поставленной цели решались следующие задачи:
1) нахождение механизма адсорбции о-толуидина на немодифицированном бентоните и в присутствии указанных модификаторов;
2) определение параметров, характеризующих эффективность адсорбции в рамках указанных моделей из экспериментальных данных.
Материалы и методы исследования
Лабораторные испытания выполнены на базе НОЦ «Промышленная экология» СГТУ имени Гагарина Ю.А. с использованием поверенного испытательного и вспомогательного оборудования. В качестве материалов использовались: соляная кислота (хч, ГОСТ 3118-77, ОАО «Башкирская содовая компания»); натрия карбонат (хч, ГОСТ 83-79, Московская химическая компания «Лаверна»); натрия натрит (чда, ГОСТ 4197-74, Московская химическая компания «Лаверна»); о-толуидин (ч, ГОСТ 6-09-2942-78,ООО «Мегахим»); динатриевая соль 2-нафтол-3,6-дисульфокислоты (ч, ТУ «6-09-07-665-76», ЗАО «Вектон»); бентониты (СанПиН 2.6.1. 758-99 SR, марка «ArmbentWT», «Bento Group Minerals», модифицированный углеродными нанотрубками и глицерином в ООО «Лисскон»). Оборудование: двухлучевой сканирующий УФ-ВИД спектрофотометр ПромЭкоЛаб ПЭ-6100УФ, весы аналитические AND HR-202. Экспериментальное определение величины адсорбционной емкости основано на определении остаточной концентрации о-толуидина в водной фазе раствора, содержащего адсорбент [13, с. 275]. Для определения этой величины 1,5 г динатриевой соли 2-нафтол-3,6-дисульфокислоты (P-кислота) растворяли в 50 мл дистиллированной воды, раствор подщелачивался раствором Na2CO3 и разбавлялся водой до объема 100 мл. Для проведения диазотирования 1 мл раствора смешивали с 1 мл 2 н соляной кислоты и добавляли 1 мл 0,25 %-ного раствора NaNO2. Через 15 минут смешивали с 10 мл 1 М раствора Na2CO3 и 0,5 мл раствора реактива, разбавляли водой до объема 25 мл и через 1 ч фотометрировали при длине волны 485 нм.
Абсолютная погрешность фотометрического эксперимента: для установки длины волны – 0,5 нм, для повторяемости установки длины волны – 0,3 нм. Относительная погрешность определения при взвешивании образцов адсорбентов составляла 1,6 %. Относительная погрешность определения оптической плотности составляла 0,25 %, относительная погрешность определения равновесной концентрации составляла 1,23 %.
Результаты исследования и их обсуждение
Адсорбция на алюмосиликатных системах может быть удовлетворительно описана уравнением Ленгмюра:
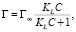 (1)
(1)
где Г – емкость адсорбции при равновесной концентрации в растворе С; Г∞ – предельная адсорбционная емкость; KL – константа равновесия процесса сорбции. Адсорбция по Ленгмюру отвечает формированию мономолекулярного слоя адсорбата на поверхности адсорбента. Максимум адсорбции наблюдается тогда, когда вся поверхность покрыта мономолекулярным слоем.
Уравнение (1) в линеаризованном виде может быть представлено следующим образом:
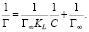 (2)
(2)
При этом величины KL и Г∞ определяются из следующих соотношений:
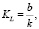 (3)
(3)
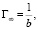 (4)
(4)
где k и b – соответственно угловой коэффициент и вертикальная отсечка линейной зависимости 1/Г vs 1/C. В рамках уравнения Фрейндлиха адсорбция может быть описана следующим образом:
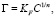 (5)
(5)
KF – константа равновесия уравнения Фрейндлиха, характеризующая адсорбционную емкость системы; 1/n – параметр, указывающий на интенсивность взаимодействия адсорбент – адсорбат. Уравнение (6) в линеаризованной форме можно представить следующим образом:
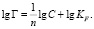 (6)
(6)
Величины KF и n определяются из следующих соотношений:
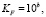 (7)
(7)
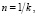 (8)
(8)
где k и b – соответственно угловой коэффициент и вертикальная отсечка линейной зависимости lgГ vs lgC. Так как адсорбционные центры по этой модели обладают различными величинами энергии, то в первую очередь происходит заполнение активных сорбционных центров с максимальной энергией.
Для сравнения модельных и экспериментальных данных использовался параметр – коэффициент детерминации R2, который рассчитывается по формуле
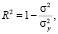 (9)
(9)
где σ2 – это дисперсия случайной ошибки модели (факторная компонента дисперсии), 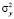 – общая дисперсия. Таким образом, коэффициент детерминации показывает долю общей дисперсии, которая может быть объяснена в рамках данной модели. Чем ближе величина R2 к 1, тем выше степень адекватности модели. Из сравнения результатов видно, что описание адсорбции о-толуидина на бентоните в отсутствии модификатора, а также в присутствии модификаторов – углеродных нанотрубок и системы глицерина и углеродных нанотрубок в лучшей степени интерпретируется в рамках модели Фрейндлиха (наибольший R2), чем в рамках модели Ленгмюра (таблица).
– общая дисперсия. Таким образом, коэффициент детерминации показывает долю общей дисперсии, которая может быть объяснена в рамках данной модели. Чем ближе величина R2 к 1, тем выше степень адекватности модели. Из сравнения результатов видно, что описание адсорбции о-толуидина на бентоните в отсутствии модификатора, а также в присутствии модификаторов – углеродных нанотрубок и системы глицерина и углеродных нанотрубок в лучшей степени интерпретируется в рамках модели Фрейндлиха (наибольший R2), чем в рамках модели Ленгмюра (таблица).
Параметры моделей адсорбции о-толуидина на бентоните в отсутствии и в присутствии модификатора, полученные в рамках моделей Ленгмюра и Фрейндлиха
|
в отсутствии модификатора |
||||
|
Вид изотермы |
Параметры изотермы |
R2 |
Регрессионная формула |
|
|
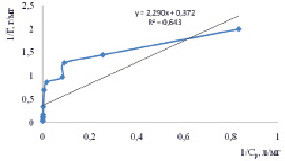
Ленгмюр |
KL = 0,162 л/мг |
Г∞ = 2,69 мг/г |
0,643 |
1/Г = 2,290(1/Сp) + 0,372 |
|
Фрейндлих |
KF = 0,241 (мг/г)?(л/мг)1/n |
n = 1,862 |
0,856 |
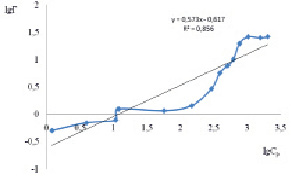
lgГ = 0,537lgCp – 0,617 |
|
бентонит, модифицированный глицерином и углеродными нанотрубками |
||||
|
Вид изотермы |
Параметры изотермы |
R2 |
Регрессионная формула |
|
|
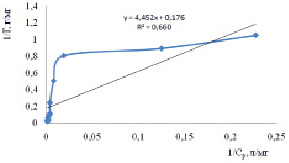
Ленгмюр |
KL = 0,039 л/мг |
Г∞ = 5,68 мг/г |
0,660 |
1/Г = 4,452(1/Сp) + 0,176 |
|
Фрейндлих |
KF = 0,361 (мг/г)?(л/мг)1/n |
n = 1,689 |
0,794 |
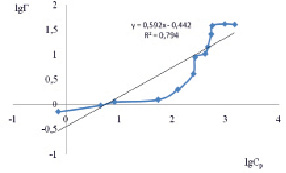
lgГ = 0,592lgCp – 0,442 |
|
бентонит, модифицированный углеродными нанотрубками |
||||
|
Вид изотермы |
Параметры изотермы |
R2 |
Регрессионная формула |
|
|
Ленгмюр |
KL = 0,043 л/мг |
Г∞ = 8,55 мг/г |
0,737 |
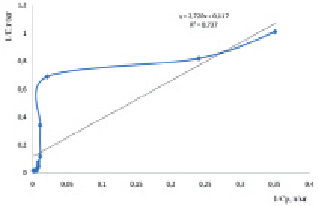
1/Г = 2,720(1/Сp) + 0,117 |
|
Фрейндлих |
KF = 0,271 (мг/г)?(л/мг)1/n |
n = 1,200 |
0,752 |
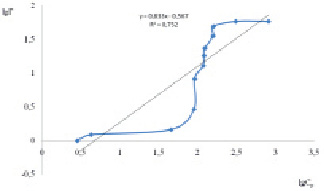
lgГ = 0,833lgCp – 0,567 |
а
б
в
Рис. 1. Изотермы адсорбции о-толуидина на немодифицированном бентоните (а) и на бентоните, модифицированном глицерином и углеродными нанотрубками (б) и углеродными нанотрубками (в) в рамках модели Ленгмюра
а
б
в
Рис. 2. Изотермы адсорбции о-толуидина на немодифицированном бентоните (а) и на бентоните, модифицированном глицерином и углеродными нанотрубками (б) и углеродными нанотрубками (в) в рамках модели Фрейндлиха
Выводы
Для каждой из исследуемых адсорбционных систем коэффициент детерминации R2 по модели Фрейндлиха выше, чем по модели Ленгмюра. Следовательно, адсорбция о-толуидина на немодифицированном бентоните, а также на бентонитах, модифицированных углеродными нанотрубками и системой «глицерин – углеродные нанотрубки», лучше интерпретируется в рамках изотермы Фрейндлиха, чем изотермой Ленгмюра.
Следует также отметить, что коэффициент детерминации R2 по модели Фрейндлиха снижается для исследуемых адсорбционных систем в следующем порядке: немодифицированный бентонит > бентонит, модифицированный системой «глицерин – углеродные нанотрубки» > бентонит, модифицированный углеродными нанотрубками. В этом же порядке возрастает коэффициент детерминации в рамках модели Ленгмюра. Возрастание величины предельной адсорбции o-толуидина в ряду адсорбентов: немодифицированный бентонит > бентонит, модифицированный системой «глицерин – углеродные нанотрубки» > бентонит, модифицированный углеродными нанотрубками – можно объяснить увеличением межслоевого расстояния и установлением межфазного распределения адсорбата в системе «адсорбент – модификатор».
Полученные результаты позволяют усовершенствовать адсорбционный процесс очистки промышленных сточных вод от ароматических аминов с помощью модификации алюмосиликатных адсорбентов малополярными поверхностно-активными веществами.
Данная работа является результатом выполнения НИР в рамках гранта для победителей конкурсного отбора проектов, выполняемых научными коллективами исследовательских центров и (или) научных лабораторий образовательных организаций высшего образования (Госзадание Минобрнауки РФ, проект 5.3922. 2017/ПЧ).



