CELLULOSE MATRIX OF ARCTIC BROWN ALGAE: PURIFICATION, STRUCTURE
Bogolitsyn K.G. 1, 2
Kaplitsin P.A. 1
Druzhinina A.S. 1
Ovchinnikov D.V. 1, 3
Shulgina E.V. 4
Parshina A.E. 1
1 Northern (Arctic) Federal University named after M.V. Lomonosov
2 Institute of Ecological Problems of the North of UB RAS
3 Shared Use of Equipment Center «Arktika», Arkhangelsk
4 Institute of Ecological Problems of the North, Ural Branch, Arkhangelsk. Northern (Arctic) Federal University named after M.V. Lomonosov
The results of research on developing a method for producing cellulose matrix of Arctic brown algae are presented. There are three steps in proposed scheme: treatment of air-dry algae with binary mixture of supercritical carbon dioxide:ethanol (1:10), extraction of the residue with a solution of hydrochloric acid and further extraction with a solution of NaHCO3. Fibrous substance was obtained as a result of the treatments. This matrix consists of cellulose and residual quantities of components contained in the algae biomass (insoluble proteins, alginic acid and insoluble forms laminirana and fucoidan, low molecular weight degradation products). The most effective method for the purification of cellulose from this substance is the treatment with 0,01 N sodium hydroxide. The morphological and structural features of produced algal cellulose are studied.
cellulose matrix
brown algae
complex processing
Бурые водоросли используются во всем мире как сырье для производства биологически активных веществ, таких как маннит, жирные кислоты, хлорофилл, соли альгиновой кислоты. В процессе получения альгинатов на одной из технологических стадий из водорослевого сырья выделяется водорослевая клетчатка, представляющая собой сложную полимерную структуру на основе целлюлозной матрицы. Так, по литературным данным, содержание водорослевой целлюлозы у Laminaria digitata может составлять 3,7 %, у Saccharina latissima – 5,7 % [9], а у Fucus vesiculosus – 4,5 % [10].
Водорослевую клетчатку можно отнести к сорбентам целлюлозного типа, и, следовательно, для исследования данного препарата применимы подходы и методы, используемые при исследовании целлюлоз.
Авторы работ [1, 2] утверждают, что выделенная клетчатка из бурых водорослей содержит углерода 40 %, водорода 6 %, серы 1,5 %, а зольность препарата составляет 11 %. Кроме того, в клетчатке наблюдается остаточное содержание альгиновой кислоты (4 %), лигнинных компонентов (2,5 %), а также микроколичества хлорофилла и каротиноидов, что обуславливает окраску препарата. Поверхность водорослевой клетчатки достаточно развита, сравнима с целлюлозами высших растений. Значение удельной площади поверхности, определенной методом тепловой десорбции азота, для водорослевой клетчатки составляет 0,6 м2/г, тогда как для МКЦ (микрокристаллической целлюлозы) 1,4 м2/г [2].
Водорослевую клетчатку можно отнести к набухающим полимерам. Надмолекулярная структура таких полимеров характеризуется существованием областей с различной степенью упорядоченности молекул, что оказывает влияние на протекание сорбционных процессов в системе «водорослевая клетчатка-раствор». С другой стороны, водорослевая клетчатка представляет собой полиэлектролит. Сорбционными центрами являются гидроксильные группы водорослевой целлюлозы и карбоксильные группы примесей. Кроме того, в ее структуре присутствуют серосодержащие группы. Таким образом, сорбция, протекающая в системе «водорослевая клетчатка-раствор соли», обусловлена двумя процессами: комплексообразование и ионный обмен [1].
По сравнению с МКЦ водорослевая клетчатка обладает более рыхлой структурой, что делает доступными реакционные центры. Следовательно, для водорослевой клетчатки характерна более высокая степень извлечения катионов металлов из раствора. Это подтверждают авторы работ [1, 2], показывая, что она обладает высокой сорбционной активностью по отношению к солям тяжелых металлов (Cd2+, Ag+, Zn2+, Cu2+, Ni2+, Pb2+, Cr2+) и может быть использована в качестве энтеросорбента.
Водорослевая клетчатка также проявляет высокую сорбционную активность по отношению к патогенным микроорганизмам и обладает иммуномодулирующим действием. Так, в работе [1] показано, что водорослевая клетчатка эффективно адсорбирует кишечные палочки, патогенные стафилококки и дрожжеподобные грибы, а также спорообразующие бациллы.
Таким образом, можно сделать вывод, что водорослевая клетчатка является ценным компонентом водорослей, обладающим высокими сорбционными свойствами по отношению к тяжелым металлам и патогенным микроорганизмам, что дает возможность использовать данный препарат как энтеросорбент. Но, несмотря на перечисленные выше свойства водорослевой клетчатки, она чаще всего является отходом производства [10].
Целью данной работы является разработка способа выделения и изучения морфологических и структурных особенностей целлюлозы арктических бурых водорослей.
Материалы и методы исследования
Объекты исследования и пробоподготовка. В качестве объектов исследования использовались бурые водоросли вида fucus vesiculosus, отобраные в ходе комплексной научно-исследовательской экспедиции «Арктический Плавучий университет – 2014», в летний период в акватории архипелага Кузова в Белом море.
В отсутствие атмосферных осадков пробы сушились до достижения воздушно-сухого состояния на открытом воздухе, в пасмурную погоду – выдерживались в сушильном шкафу при температуре 30 ± 1 °С [8]. Далее образцы усреднялись и хранились в герметичной стеклянной таре в темном помещении.
Определение состава водорослей и водорослевых экстрактов. Общий химический состав (содержание воды, золы, альгиновых кислот, маннита) водорослей определялся по общепринятым методикам [5].
Суммарное содержание полифенольной фракции определяли спектрофотометричеким методом с применением реактива Folin-Ciocalteu по [4]. В качестве стандарта использовали флороглюцин.
Содержание хлорофилла и каротиноидов определяли хроматографически на ВЭЖХ системе LC-30 «Nexera»(Колонка Luna C-18 (Phenomenex)) при длине волны 665 нм для хлорофилла и при 440 нм для каротиноидов.
Аминокислотный состав исследовался методом ВЭЖХ на аминокислотном анализаторе Biochrom 30+ после полного кислотного гидролиза пептидных связей раствором 6М соляной кислоты, в соответствии с ГОСТ [3].
Получение и очистка клетчатки
При проведении экстракции бурых водорослей по предлагаемой нами комплексной схеме переработки (рис. 3) выделяется клетчатка. Образец высушивали лиофильно, перемалывали, подвергали химическому анализу и дальнейшей обработке. Очистку клетчатки проводили с помощью растворов щелочей и воды.
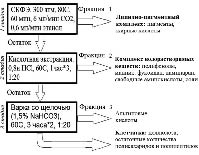
Рис. 3. Предлагаемая схема выделения целлюлозной матрицы из арктических бурых водорослей
Обработка водой проводилась при непрерывном перемешивании при 90 °С, гидромодуль 1:20, количество стадий от 1 до 4 (каждая по 60 минут). Щелочные обработки образцов проводились растворами NaOH (0,01н, 0,1н, 1,0 н) при перемешивании при 90 °С, гидромодуль 1:20, количество стадий 4 (каждая по 60 минут).
Степень очистки клетчатки оценивали по выходу массы после отмывки, относительно массы клетчатки, взятой на очистку, а также оценивали степень деструкции водорослевой целлюлозы по её выходу. Снимки водорослевой клетчатки получали на сканирующем электронном микроскопе SEM Sigma VPZEISS (ускоряющее напряжение 20 кВ, детектор InLens).
Определение содержания целлюлозы. Навеску растительного материала помещали в колбу, соединенную с притертым обратным холодильником, и приливали смесь, состоящую из 75 мл 80 %-й уксусной кислоты и 5 мл азотной кислоты (уд. вес 1,4). Содержимое колбы кипятили при осторожном подогревании в течение 20 минут, далее фильтровали. Клетчатку на фильтре промывали спиртом, затем эфиром, высушивали и взвешивали [6]. Содержание клетчатки рассчитывали в процентах по отношению к исходной навеске на абсолютно сухое вещество.
Запись ИК-спектров продуктов переработки водорослей. Для исследования использован метод инфракрасной спектроскопии нарушенного полного внутреннего отражения (НПВО) с использованием ИК-Фурье-спектрометра Vertex 70 (Bruker, Германия) и НПВО с алмазным кристаллом GladiATR (Pike Technologies, США). Условия записи спектров: диапазон 4000–400 см-1, разрешение 4 см-1, 128 сканирования. Сравнение полученных спектров со спектром МКЦ проводилось в области от 1800 до 800 см-1 .
Определение степени кристалличности. Образцы водорослей и клетчатки были проанализированы на рентгеновском дифрактометре ShimadzuXRD-7000 S в порошкообразном виде. Дифрактограмму записывали с вращением (30 об./мин).
Оптическая схема гониометра q – 2q, детектор сцинтилляционный, с монохроматором. Параметры работы рентгеновской трубки: при записи обзорных дифрактограмм ускоряющее напряжение 40 кВ, ток 30 мА, материал мишени – Cu; при определении степени кристалличности – ускоряющее напряжение 50 кВ, ток 30 мА, материал мишени – Cu. Диапазон сканирования по углу 2q: при записи обзорных дифрактограмм – от 10 до 150 °, скорость сканирования 2,0 град/мин, шаг 0,02 °; при определении степени кристалличности – от 10 до 70 °, скорость сканирования 0,5 град/мин, шаг 0,02 °. Степень кристалличности определялась поиском соответствия в базе данных PDF-2 (PowderDiffractionFile™ PDF-2 Release 2010, International Centre for Diffraction Data) для полученных обзорных дифрактограмм.
Результаты исследования и их обсуждение
Характеристика исходного сырья. Исходное сырье fucus vesiculosus для выделения водорослевой целлюлозы является воздушно-сухим и содержит 9 % влаги. Для изучения морфологической структуры таллома бурой водоросли на микроуровне нами был применен метод электронной микроскопии. Как видно на снимках (рис. 1 и 2), срез таллома исходных водорослей имеет плотную, слоистую структуру. На поверхности наблюдается незначительная складчатость.
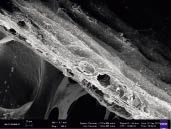
Рис. 1. Изображение среза таллома (200 кр приближение)
Анализ компонентного состава данного сырья показал, что основными компонентами являются альгиновые кислоты (26,2 % масс), минеральные вещества (23,7 % масс), фукоидан (9,8 % масс), целлюлоза (8,5 % масс), полифенольные вещества (8,1 % масс), белки и свободные аминокислоты (7,2 % масс), хлорофилл (0,24 мг/г), каротиноиды (0,0052 мг/г).

Рис. 2. Изображение среза таллома (1000 кр приближение)
При анализе литературных данных и с учетом выявленного компонентного состава предложена следующая схема выделения целлюлозы из арктических бурых водорослей (рис. 3).
В качестве первой стадии схемы выделения водорослевой целлюлозы предлагается сверхкритическая флюидная экстракция бинарным растворителем «сверхкритический диоксид углерода – этанол (10:1)». На данной стадии происходит выделение липидно-пигментного комплекса, содержащего жирные кислоты, хлорофилл и каротиноиды. Параметры экстракции: размер фракции 0,2–0,03 мм, влажность сырья 9 % масс, температура 80 °С, давление 300 атм, время экстракции 60 мин, расход углекислого газа 6 мл/мин, расход этанола 0,6 мл/мин. Выход хлорофилла составляет 62,5 % отн, каротиноидов 76,9 % отн, жирных кислот 99 % отн. На снимках видно, что после стадии СКФЭ клетки расправляются и на срезе таллома хорошо наблюдаются отдельные ткани (эпидермальные клетки, проводящие системы и т.п.) (рис. 4 и 5). Поверхность таллома становится гораздо более развитой за счёт истончения липидных мембран клеток. Таким образом, СКФЭ приводит к активации растительной матрицы для последующей ее модификации.
На второй стадии экстракции извлекается комплекс водорастворимых веществ (маннит, ламинаран, фукоидан, полифенолы, белки и аминокислоты). Для этих целей подходит несколько растворителей или систем: вода, раствор слабой минеральной кислоты, водно-спиртовые смеси и раствор ферментов. Наибольшего выхода экстракции удалось добиться при кислотной обработке биомассы 0,8 н HCl при 60 °С в три стадии по 1 часу, гидромодуль 1:20. Выход компонентов, относительно их содержания в водоросли составляет: маннит 96 % отн, полифенольные вещества 85,0 % отн, легкогидролизуемые полисахариды 59,7 % отн.
 Рис. 4. Изображение среза таллома, обработанного сверхкритическим флюидом (200 кр приближение)
Рис. 4. Изображение среза таллома, обработанного сверхкритическим флюидом (200 кр приближение)

Рис. 5. Изображение среза таллома, обработанного сверхкритическим флюидом (1000 кр приближение)
На третьей стадии из остатка после кислотной экстракции проводится выделение альгиновых кислот обработкой щелочью (1,5 % NaHCO3) при 90 °С в 2 стадии, каждая стадия по 3 часа, гидромодуль 1:20.
При проведении экстракции бурых водорослей по предлагаемой нами комплексной схеме переработки, образуется клетчатка, содержащая целлюлозу и остаточные количества компонентов, содержащихся в биомассе водоросли (нерастворимые белки, альгиновые кислоты, нерастворимые формы ламинирана и фукоидана, низкомолекулярные продукты деструкции водорослевых компонентов).
По результатам проведенных исследований, в исходных водорослях fucus vesiculosus содержание целлюлозы составляет 8,5 % масс, что несколько выше литературных данных (4,5 %), однако компонентный состав водорослей варьируется в широких пределах, в зависимости от множества факторов (гидродинамический режим, температура, соленость воды и т.п.). В ходе химической переработки по предложенной нами схеме, содержание целлюлозы в клетчатке снижается до 2,2 % масс (в пересчете на массу водоросли), что указывает на её значительную химическую деструкцию и растворение в щелочи в ходе обработок (таблица).
При отмывке клетчатки водой происходит процесс экстракции относительно низкомолекулярных, растворимых в воде примесей (остатки водорастворимых полисахаридов и продукты их деструкции). За счет чего происходит снижение массы клетчатки (до 42,1 % от исходной) и одновременное увеличение доли целлюлозы в массе, до 22,5 %. Целлюлоза не подвергается значительной деструкции (выход 90,9 %). ИК-спектр полученной клетчатки совпадает на 85,6 % со спектром МКЦ, а степень кристалличности увеличивается с 20,6 % до 40,4 %. При отмывке водой на волокнах остается значительное количество сорбированного вещества и поверхность слабо развита (рис. 6).
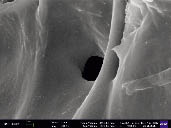
Рис. 6. Изображение массы, полученной в ходе отмывки водорослевой клетчатки водой (5000 кр увеличение)
В результате водной экстракции в целлюлозной матрице остается значительное количество примесей, не растворимых в воде (белки, альгиновые кислоты, лигнанные соединения), которые могут быть извлечены растворами щелочи. При отмывке клетчатки 0,01 н раствором NaOH происходит снижение массы клетчатки до 25,2 %, при этом целлюлоза подвергается частичной деструкции (выход 72,7 %), однако её доля в массе увеличивается до 29,6 %.
На рис. 7 и 8 показаны снимки образцов клетчатки, отмытой раствором 0,01н гидроксида натрия. Здесь отчетливо видны микрофибриллы целлюлозы, толщина которых составляет 30 нм, при этом она совпадает с толщиной последних в исходной водоросли и у высших растений. Данный факт указывает, что микрофибриллы в ходе обработок не истончаются. Более того, на рис. 8 видны довольно длинные микрофибриллы (8 и более мкм), что указывает на высокую степень полимеризации целлюлозы.
С увеличением концентрации щелочи происходит интенсификация как процессов удаления примесей, так и деструкции целлюлозы. Так, при экстракции 1 н раствором гидроксида натрия, выход целлюлозы снижается до 10 %. ИК спектр клетчатки, отмытой 0,01 н раствором, совпадает на 91,3 % со спектром МКЦ, что указывает на высокое содержание целлюлозы в полученной клетчатке.

Рис. 7. Изображение массы, полученной в ходе отмывки водорослевой клетчатки раствором щелочи (5000 кр увеличение)

Рис. 8. Изображение массы, полученной в ходе отмывки водорослевой клетчатки раствором щелочи (50 000 кр увеличение)
Характеристика водорослевой клетчатки
|
№
п/п
|
Экстра-гент
|
Стадия
обработки
|
Выход массы, % отн от массы клетчатки
|
Выход целлюлозы, % отн от целлюлозы в клетчатке
|
Доля целлюлозы, % отн
|
Совпадение ИК спектра со спектром МКЦ,%
|
Степень кристал-личности, %
|
|
1
|
–
|
Клетчатка
|
100
|
100
|
10,4
|
66,2
|
20,6
|
|
2
|
Вода
|
1 стадия
|
76,4
|
100
|
13,4
|
–
|
–
|
|
2 стадии
|
53,6
|
90,9
|
17,4
|
–
|
–
|
|
3 стадии
|
43,3
|
91,9
|
21,5
|
–
|
–
|
|
4 стадии
|
42,1
|
90,9
|
22,2
|
85,6
|
40,4
|
|
3
|
Водный раствор NaOH
|
0,01н
|
25,2
|
72,7
|
29,6
|
91,3
|
40,9
|
|
0,1н
|
21,0
|
59,1
|
28,9
|
91,2
|
41,8
|
|
1,0 н
|
10,6
|
22,7
|
21,7
|
95,7
|
43,7
|
Выделенная в ходе обработок водорослевая целлюлоза по своим характеристикам близка к характеристикам низкосимметричной целлюлозы I? (рис. 9) с одноцепочечной триклинной элементарной ячейкой [7].
Рис. 9. Модель целлюлозы I?
Предложена схема выделения целлюлозной составляющей арктических бурых водорослей. Наиболее эффективным, при этом щадящим для целлюлозы способом очистки водорослевой клетчатки от побочных веществ (содержание целлюлозы 30 %) является обработка 0,01н раствором гидроксида натрия.
Установлено, что структура водорослевой целлюлозы близка к типу I? и не подвергается значительным изменениям в ходе извлечения биологически активных веществ.
Научно-исследовательская работа выполнена в рамках проектной части государственного задания Министерства образования и науки РФ в сфере научной деятельности № 4.1288.2014/К. С использованием оборудования ЦКП НО «Арктика» Северного (Арктического) федерального университета имени М.В. Ломоносова при финансовой поддержке Министерства образования и науки РФ (уникальный идентификатор работ RFMEFI59414X0004, соглашение № 14.594.21.0004 от 15 августа 2014 года).







 Рис. 4. Изображение среза таллома, обработанного сверхкритическим флюидом (200 кр приближение)
Рис. 4. Изображение среза таллома, обработанного сверхкритическим флюидом (200 кр приближение)