Угревая болезнь (УБ) или акне – представляет собой одну из распространенных патологий в дерматологии и косметологии. Согласно различным источникам, угревой болезнью страдает 85 % людей в возрасте от 12 до 24 лет. В возрастных группах 25-34 и 35-44 года заболеваемость составляет 8 и 3 % соответственно [5, 6].
Актуальность проблемы обусловлена не только высокой заболеваемостью, рецидивирующим или тяжелым течением, но и трудностями в терапии и вторичной профилактике заболевания УБ. При акне, в отличие от многих дерматозов, поражается преимущественно лицо, которое является одним из главных и основных звеньев межличностной и социальной коммуникации [7]. В соответствии с этим УБ можно выделить в число заболеваний, имеющих социальное значение, а поиск путей эффективного лечения является актуальной задачей, требующей междисциплинарного подхода и глубокого понимания сути заболевания.
Согласно современным представлениям, патогенез угревой болезни тесно связан с гиперсекрецией кожного сала и повышенной пролиферативной активностью в зоне волосяного фолликула, интенсивной и избыточной колонизацией кожи и придатков propionibacterium acnes (P. acnes), вызывающих воспалительную реакцию [5]. Есть данные в литературе, подтверждающие влияние гиперандрогении на фолликулярную кератинизацию [6]. Основное значение в развитии акне ряд авторов придают наследственной предрасположенности. Вероятность развития акне у подростков в случае болезни обоих родителей составляет 50 %. Установлено, что чем тяжелее степень акне, тем чаще прослеживается генетическая взаимосвязь с наличием данного заболевания у ближайших родственников [9].
Отмеченные звенья патогенеза УБ напрямую связаны с функционированием системы «перекисное окисление липидов – антиоксидантная защита» (ПОЛ-АОЗ), в связи с чем теоретический и практический интерес представляет изучение состояния данной системы у пациентов с целью расширения диагностической базы и повышения контроля качества проводимой терапии.
Наиболее мощный поток первичных свободных радикалов и вторичных продуктов их превращения исходит из гранулоцитов и макрофагов как резидентных, так и мигрирующих в кожу. Вырабатываемые нейтрофилами активные формы кислорода (АФК) принимают участие в повреждении и деструкции стенок фолликула при акне. Установлено, что накопление продуктов свободнорадикального окисления липидов оказывает повреждающее действие на клеточные мембраны не только отдельных клеток, но и на уровне целостного организма, приводя к нарушению функции многих органов и иммунокомпетентных клеток [4].
Несмотря на многочисленные клинические и лабораторные исследования, многие вопросы патогенеза данного заболевания продолжают оставаться неизученными. В связи, с чем отсутствуют эффективные методы лечения и профилактики рецидивов.
При этом особенную модифицирующую роль как в этиологии, так и механизмах патогенеза заболевания играют экологические факторы. Установлено, что приоритетные для РСО-А техногенные загрязнители – ионы тяжелых металлов обладают поливалентным действием, являясь в ряде случаев не только причиной болезней кожи, но и изменений в иммунной системе, повышенной сенсибилизации организма и т.д. Данное обстоятельство обусловливает акцентирование исследований УБ в популяциях жителей, проживающих в местах с неблагоприятным экологическим фоном, к числу которых несомненно относится республика Северная Осетия [1].
Работы по изучению ПОЛ-АОС у больных вульгарными угрями немногочисленны. Однако комплексной оценки данной системы при угревой болезни не проводилось.
Цель исследования. Цель исследования заключалась в изучении заболеваемости угревой болезнью среди взрослого населения в РСО-А за период с 2007 по 2011 гг., и выявлении оксидантного и антиоксидантного статуса у наблюдаемых больных.
Материалы и методы исследования
Заболеваемость УБ в РСО-А среди взрослого населения с 2007 по 2011 гг. определяли по данным поликлинического приема (амбулаторные карты, журналы регистрации больных) и стационара (истории болезни) республиканского кожно-венерологического диспансера.
Нами было обследовано 30 больных УБ с папуло-пустулезной формой легкой и средней степени тяжести в возрасте от 18 до 32 лет. Из них 16 мужчин и 14 женщин. Из обследованных пациентов у 23 человек был выявлен дисбактериоз кишечника 1 и 2 степени. Сопутствующей патологии других органов и систем не выявлено. Контрольную группу составили 20 практически здоровых лиц соответствующего возраста без признаков кожной патологии. Кровь бралась в первой половине дня из локтевой вены в количестве 5 мл с антикоагулянтом (гепарин). Продукты перекисного окисления липидов в плазме крови и эритроцитах – малоновый диальдегид (МДА), гидроперекисей (ГП) и одно из ферментных систем, системы АОЗ – каталаза, определялись биохимическими методами. МДА определяли по реакции с тиобарбитуровой кислотой [3], ГП по Гаврилову, каталазу по T. Beutler [2].
Результаты лабораторных исследований подвергали статистической обработке с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
За рассматриваемый период в РКВД обратились 1114 больных акне в возрасте 18 – 32 лет, причем, количество обратившихся ежегодно возрастало (рис.1). При этом, так же ежегодно возрастала доля больных в возрасте 27-32 лет (рис. 2). Общее количество мужчин составило 724 (65 %), женщин – 390 (35 %). У 25 % пациентов имелась легкая форма акне, у 48 % – средняя, у 27 % – тяжелая форма.
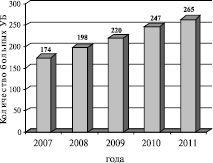
Рис. 1. Заболеваемость УБ в РСО-Алании в период с 2007 по 2011 гг. (на 100 тыс. населения)
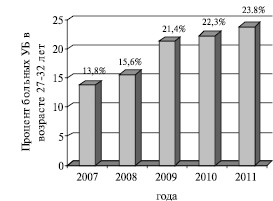
Рис. 2. Количество больных УБ в возрасте 27-32 лет в 2007-2011 гг.
Результаты исследования некоторых звеньев системы ПОЛ-АОЗ у больных угревой болезнью
|
Показатели |
Контрольная группа (n=20) |
Больные угревой болезнью (n=30) |
Р |
|
ГП (мкмоль/л) |
3,689±0,454 |
5,821±0,799 |
н/д |
|
МДА (мкмоль/л) |
38,092±2,582 |
50,005±4,614 |
н/д |
|
Каталаза (104)МЕ/г Hb |
21,096±0,561 |
12,083±0,987 |
0,001 |
Анализ приведенных в таблице данных позволяет заключить, что развитие угревой болезни сопровождается значительными изменениями в системе ПОЛ-АОЗ, что выражается активацией процессов перекисной направленности и угнетением ферментативных звеньев антиоксидантой защиты.
Патологические сдвиги фиксируются уже на начальных звеньях процессов ПОЛ – образование гидроперекисей у больных на 63 % оказывается более повышенным по сравнению с контрольной группой. Известно, что гидрофильный характер образовавшихся первичных продуктов ПОЛ является причиной их активной диффузии из бислоя мембран [8]. Это обстоятельство замыкает патологический круг болезни: клетки обретают повышенную чувствительность к возбудителям, в том числе к P. acnes, и болезнь может прогрессировать. Дополнительным, подтверждающим негативное течение патологического процесса обстоятельством является также повышенное содержание у больных вторичного продукта деструкции мембран – малонового диальдегида. Это может свидетельствовать о факте истощения в организме антиоксидантого пула, составленного из естественных биоантиоксидантов и прежде всего альфа-токоферола, который способен не только обрывать цепные реакции окисления липидов, но и восстанавливать образующиеся гидроперекиси. Высокая реакционная способность МДА обусловливает его токсические свойства, в том числе мутагенные, и приводит к накоплению в клетках «шлаков» – оснований Шиффа, что является дополнительной нагрузкой для клеток, активно вовлеченных в патологический процесс [10].
Известно, что дисбаланс в системе ПОЛ может протекать не только на фоне изменений в неферментативном звене антиоксидантной защиты, но также и затрагивать отдельные энзиматические защитные механизмы. Для подтверждения данной гипотезы в качестве маркерного фермента нами выбрана каталаза, разрушающая эндогенную перекись водорода, и, тем самым, разрывающая патологический круг реакций из цикла Габера-Вейса.
В нашем случае патологическую картину усугубляет достоверное снижение активности каталазы у больных относительно группы здоровых лиц. Это может приводить к повышенному накоплению в клетках перекиси водорода, взаимодействие которой с ионами железа приводит к образованию гидроксильных радикалов – инициаторов ПОЛ.
Выводы
Таким образом, развитие патологического процесса у больных угревой болезнью протекает на фоне активации свободнорадикальных процессов с угнетением одного из основных звеньев системы антиоксидантной защиты – каталазы. Данное обстоятельство является основанием для проведения дальнейших исследований по изучению корригирующего действия применяемой терапии на состояние антиоксидантного статуса больных УБ.



