Экстракционные свойства диантипирилалканов достаточно полно изучены в случае жидкостной экстракции, но возможность их применения в случае экстракции расплавами не изучалась.
В настоящей работе приведены сведения об экстракции ионов кобальта расплавами смесей диантипирилалканов (ДАА) с бензойной кислотой (БК).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Стандартный раствор сульфата кобальта (0,1 моль/л) готовили растворением навески CoSO4×7H2O в дистиллированной воде. Титр определяли комплексонометрически [6]. В качестве экстрагентов применяли диантипирилметан (ДАМ) и его алкильные гомологи: пропилдиантипирилметан (ПДАМ), бутилдиантипирилметан (БДАМ), изобутилдиантипирилметан (ИБДАМ) и гексилдиантипирилметан (ГДАМ).
Экстракцию проводили в градуированных пробирках с притертыми пробками (V = 20 мл) при нагревании на водяной бане в течение 15 минут, которых достаточно для установления равновесия. Необходимую концентрацию ионов водорода создавали введением определенного количества соответствующей кислоты. Количество ионов кобальта в расплаве определяли комплексонометрически с индикатором мурексид.
Для установления состава экстрагируемых соединений применяли метод насыщения, а также химический анализ на все компоненты.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Установлено, что при нагревании до 80-90ºС в исследуемых системах ДАА - БК - НХ - H2O при кислотности среды 0,01-4,0 моль/л происходит расслаивание водной фазы (где НХ - минеральная кислота). В этом случае при нагревании происходит образование второй жидкой фазы - расплава, т.е. протекает процесс обычной жидкофазной экстракции. Но при охлаждении системы до комнатной температуры расплав застывает и образуется твердая фаза. Область устойчивого жидкофазного равновесия в системе с ДАА и БК существует в широком интервале концентраций HCl и H2SO4. Нижняя жидкая фаза (расплав), которая является экстрагентом, при охлаждении застывает, однако при этом обеспечивает количественное извлечение ионов Со(II) при 0,25-2,0 моль/л HCl [5].
Как видно из рис. 1, извлечение ионов кобальта повышается с увеличением СHCl и достигает максимума при 0,25 - 0,5 моль/л HCl. Дело в том, что на экстракцию комплексных анионов (при постоянной концентрации тиоцианат-ионов) влияет концентрация однозарядного катиона реагента, которая, соответственно растет с увеличением кислотности среды. При концентрации HCl большей 0,5 моль/л наблюдается незначительное уменьшение степени извлечения кобальта (II), что, с одной стороны, связано с увеличением концентрации тиоциановодородной кислоты HSCN, которая конкурирует с ионом металла за реагент, а с другой, может быть связано с разрушением HSCN в сильнокислой среде, о чем свидетельствует запах выделяющегося сероводорода. Наиболее перспективным реагентом следует считать ПДАМ, коэффициент распределения кобальта для которого остается практически постоянным до 3 моль/л HCl. Для других реагентов с увеличением концентрации неорганической кислоты экстракция кобальта уменьшается, что связано с извлечением сверхстехиометрических количеств тиоциановодородной кислоты HSCN (R : HSCN = 1 ÷ 2-3).
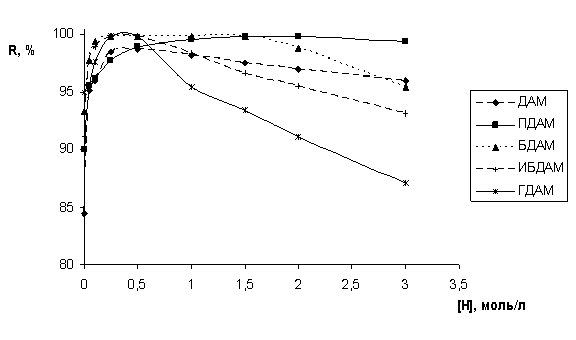
Рис. 1. Зависимость степени извлечения Со(II) от концентрации HCl различными диантипирилалканами (nБК = nДАА = 0,002 моль, ССо = 0,01 моль/л, СSCN_ = 0,25 моль/л, Vобщ. = 20 мл)
Состав извлекающихся комплексов для всех ионов металлов определяли методом насыщения и химическим анализом экстрактов на все компоненты. Результаты химического анализа приведены в табл. 1.
Таблица 1. Химический анализ экстрактов, содержащих ионы Co
|
Определяемый компонент |
Содержание компонентов в экстракте n×10-4, моль |
|
ДАМ |
8,1 |
|
Со2+ |
4,0 |
|
H+ |
8,1 |
|
SCN- |
16,4 |
Из данных табл. 1 следует следующее соотношение компонентов в комплексе: ДАМ:Н+:Со2+:SCN- = 2 : 2 : 1 : 4,3, т.е. в органическую фазу извлекается ацидокомплекс состава (LH)2[Со(SCN)4.
В дальнейшем была изучена зависимость степени извлечения Со от концентрации тиоцианат-ионов с целью составить ряд диантипирилалканов по способности извлекать тиоцианатный комплекс кобальта. Отношение R:Co в извлекающемся комплексе близко 2:1 (рис. 2), что свидетельствует об экстракции кобальт-тиоцианатного ацидокомплекса.

Рис. 2. Зависимость степени извлечения Со различными ДАА от концентрации тиоцианат-ионов (nДАА = nБК = 0,002 моль, СН+ = 0,25 моль/л, СМе = 0,01 моль/л, Vобщ. = 20 мл)
Как следует из рис. 2, введение тиоцианат-ионов увеличивает эффективность экстракционных систем ДАА - БК - HCl - вода. При этом надо отметить, что для обеспечения полноты извлечения Со требуется более высокая концентрация тиоцианат-ионов, чем ожидается в соответствии со стехиометрией по комплексу.
По значениям СSCN- при 50%-ной экстракции кобальта были рассчитаны приближенные значения констант экстракции и констант распределения комплексов [1].
Экстракция ионов металлов из тиоцианатных растворов реагентами группы ДАМ осуществляется посредством образования как тиоцианатных ацидокомплексов металлов, так и катионных форм реагента.
Основной процесс образования ацидокомплекса иона кобальта можно описать следующим уравнением:
Co(SCN)2,в + 2SCN-в = Co(SCN)42-o
Константа образования и экстракции кобальта имеет вид:
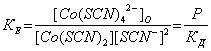 (1)
(1)
где Р - константа распределения комплекса Co(SCN)2+nn- между органической и водной фазами;
Кд - константа диссоциации комплексного аниона кобальта в водной фазе:
![]() (2)
(2)
Логарифмируя и преобразовывая выражение константы КЕ, получаем:
![]() (3)
(3)
Можно рассчитать приближенно значение константы распределения Co(SCN)42- между водным раствором и расплавом. При 50%-ной экстракции, когда наблюдается равенство [Co(SCN)2+nn-]o = [Co2+]в , получаем, что
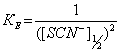 (4)
(4)
где [SCN-]n1/2 - концентрация тиоцианат-ионов, при которой кобальт извлекается на 50%.
Следовательно, приближенную величину константы распределения иона металла между водной и органической фазами можно вычислить по формуле:
![]() (5)
(5)
Из литературных данных [4] известно, что для [Co(SCN)2] pK1,2 = 3,0, а для Co(SCN)42-] pK1,2,3,4 = 2,2. Тогда,
![]() (6)
(6)
Определив [SCN-]1/2 и зная значение КД, можно рассчитать приближенные значения констант экстракции и констант распределения комплексных соединений кобальта в системах с различными ДАА. Результаты расчета приведены в табл. 2.
Таблица 2. Приближенные значения констант распределения тиоцианатных комплексов кобальта в системах ДАА - БК - HCl - вода
|
Реагент |
[SCN-]1/2, моль/л |
Ке |
lgP |
|
ДАМ |
0,055 |
330 |
3,32 |
|
ПДАМ |
0,070 |
204 |
3,11 |
|
БДАМ |
0,060 |
278 |
3,24 |
|
ИБДАМ |
0,043 |
541 |
3,53 |
|
ГДАМ |
0,0069 |
210 |
3,12 |
Соответственно табл. 2 составлен ряд реагентов по их способности извлекать тиоцианатный комплекс кобальта: ИБДАМ > ДАМ > БДАМ > ГДАМ > ПДАМ. Как видно, лучшим реагентом является ИБДАМ, что объясняется его максимальной способностью образовывать расплавы.
Проведенные исследования позволяют выделить некоторые особенности экстракции металлов расплавами реагентов, по сравнению с жидкостной экстракцией:
- Расширяется интервал концентраций ионов водорода, в котором происходит количественное извлечение ионов металлов (за счет этого увеличивается число экстрагирующихся элементов);
- Ускоряется процесс экстракции, т.к. экстракция протекает при нагревании;
- Можно осуществлять количественную экстракцию при соотношении объемов фаз примерно 1:100, что позволяет проводить значительное концентрирование;
- Происходит увеличение по сравнению с жидкостной экстракцией концентраций реагентов в органической фазе, которые превышают предельные значения растворимости этих реагентов в органических растворителях в несколько раз.
СПИСОК ЛИТЕРАТУРЫ:
- Бабко А.К., Шевчук И.А., Дегтяренко Л.И. // Труды комиссии по аналитической химии. 1963. Т.14. С.148.
- Лобанов Ф.И., Леонов В.А., Стефанов А.В., Гибало И.М. // Журн. неорган. химии. 1977. Т.22. №11. С.3097.
- Лобанов Ф.И. Экстракция неорганических соединений расплавами органических веществ. М., 1980. 84 с. (Итоги науки и техники. Неорг. химия. Т.7). - В надзаг.: АН СССР. Всесоюз. ин-т науч. и техн. информации.
- Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1971. 454 с.
- Пат. 2279673 Российская Федерация, МПК G 01 N 31/16, B 01 D 11/04. Способ определения кобальта / Дегтев М.И., Аликина Е.Н.; заявл. 03.06.05; опубл. 10.07.06, Бюл. № 19.
- Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970. 380 с.



