Известно, что поверхность потенциальной энергии (ППЭ) молекул шестичленных борных эфиров - 1,3,2-диоксаборинанов - содержит один или два (для замещенных аналогов) минимума - конформеры софы (С) - и один максимум - форму 2,5-твист (2,5-Т), а конформационная изомеризация в отличие от неборных аналогов - 1,3-диоксанов - предполагает однобарьерный переход между минимумами [2,5-9].
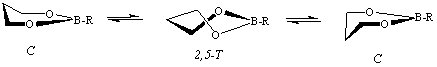
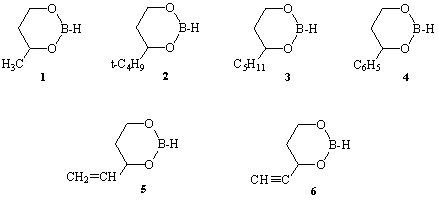
Ранее [10,11] нами была подробно изучена применимость квантово-химических методов к определению структурных и геометрических характеристик циклических борных эфиров. Целью настоящей работы является исследование маршрута конформационной изомеризации молекул модельных 4-замещенных 1,3,2-диоксаборинанов 1-6 с помощью полуэмпирического (АМ1) и неэмпирических (RHF//STO-3G, RHF//3-21G) методов в рамках программного обеспечения HyperChem [12].
Известно [1,2.5,6], что главным минимумом на ППЭ эфиров 1-4 является экваториальный конформер софы (Се). Нами обнаружено, что конформационная изомеризация между минимумами Се и Са (аксиальный конформер софы) может проходить по двум маршрутам, включающим переходные состояния 2,5-Те и 2,5-Та.
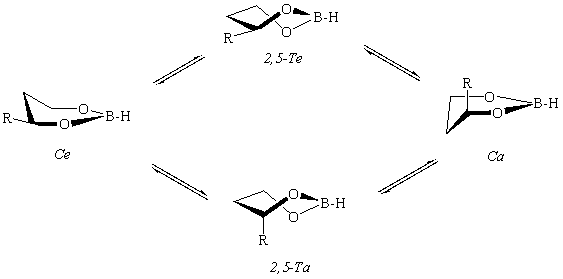
Таблица 1. Относительная стабильность минимумов и максимумов на ППЭ эфиров 1-6 (ккал/моль)
|
Соединение |
Метод расчета |
∆Е* |
∆∆Е≠* |
∆Е≠ |
|
1 |
АМ1 STO-3G 3-21G |
0.3 0.9 0.6 |
0.02 0.4 0.1 |
3.7 7.0 - 8.0 8.3 - 8.4 |
|
2 |
АМ1 STO-3G 3-21G |
1.8 3.5 3.8 |
0.4 1.1 2.0 |
4.1 - 4.5 6.9 - 8.0 8,0 - 10.0 |
|
3 |
АМ1 STO-3G 3-21G |
0.3 1.0 0.7 |
0.04 0.6 0.4 |
3.8 6.9 - 7.5 8.2 - 8.6 |
|
4 |
АМ1 STO-3G 3-21G |
0.3 1.0 0.1 |
0.06 1.0 1.3 |
3.9 7.2 - 8.2 8.6 - 9.9 |
|
5 |
АМ1 STO-3G 3-21G |
0.1 0.7 0.5 |
-0.1 0.2 0.3 |
3.7 - 3.8 7.1 - 7.3 8.5 - 8.8 |
|
6 |
АМ1 STO-3G 3-21G |
-0.7 -0.3 -2.1 |
-0.8 0 -1.4 |
3.7 - 4.5 7.4 9.1 - 10.4 |
*) Отрицательные значения свидетельствует о более стабильных формах Са либо 2,5-Та
Полученные данные (таблица 1) свидетельствуют об энергетической предпочтительности формы 2,5-Те для эфиров 1-5. При этом различия в энергии между переходными состояниями 2,5-Те и 2,5-Та (∆∆Е≠) в зависимости от метода расчета и характера заместителя R составляют от 0.1 и менее до 2.0 ккал/моль. Как и следовало ожидать, увеличение конформационного размера алкильного заместителя (эфиры 1-3) приводит к возрастанию ∆Е и ∆∆Е≠. При этом метильная и пентильная группы достаточно схожи между собой. Уменьшение конформационного объема R за счет появления двойной связи (эфир 5) обуславливает уменьшение значений ∆Е и ∆∆Е≠. В случае 4-этинил-1,3,2-диоксаборинана (6) аксиальная ориентация заместителя R становится более предпочтительной. Выигрыш в энергии между формами Се и Са достигает 2.1 ккал/моль в пользу последней (RHF//3-21G). Максимум - форма 2,5-Та - в этом случае также более стабильна, чем 2,5-Те. Во всех случаях характер заместителя R слабо влияет на высоту потенциального барьера ∆Е≠.
Таким образом, детальный анализ конформационных превращений 4-замещенных 1,3,2-диоксаборинанов указывает на два различных маршрута конформационного перехода Се ↔ Са; их относительный вклад определяется стерическими и электронными характеристиками заместителя у атома С-4 гетероциклического кольца.
СПИСОК ЛИТЕРАТУРЫ:
- Грень А.И., Кузнецов В.В. Химия циклических эфиров борных кислот, Наукова думка, Киев, 1988. - 160 с.
- Кузнецов В.В. Синтез, конформационный анализ и химические превращения циклических борных эфиров диолов и аминоспиртов, Дис. докт. хим. наук, Уфа, 2002.
- Kliegel W. Die Pharmazie, 27, 1 (1972).
- Кузнецов В.В. // Изв. АН. Сер. хим. - 2005. - № 7. - С.1499-1507.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В. // Современные наукоемкие технологии - 2006. - №2. - С. 72-74.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В. // Башкир. хим. журн. 2004. - Т.11, №1. - С.79-80.
- Курамшина А.Е., Файзуллин А.А., Бочкор С.А., Кузнецов В.В. // Башкир. хим. журн. 2004. - Т.11, №1. - С.81-82.
- Мазитова Е.Г., Курамшина А.Е., Кузнецов В.В. // ЖОрХ - 2004. - Т.40, №4. - С. 615-616.
- Курамшина А.Е., Бочкор С.А., Кузнецов В.В. // Фундаментальные исследования - 2006. - № 3. - С.87-88.
- Кузнецов В.В. // Журн. структ. химии. - 2001. - Т.42, №3. - С.591-597.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В. // Современные наукоемкие технологии - 2006. - №2. - С. 71-72.
- HyperChem 5.02. Trial version. http://www.hyper.com/.



