В настоящее время не только за рубежом [11], но и в России широко ведутся исследования свойств, получения и применения бактериальной целлюлозы (БЦ). На основе бактериальной целлюлозы получены карбоксиметильные производные с высокой степенью замещения [4]. Выделены новые эффективные целлюлозосинтезирующие штаммы [5]. Исследовано применение БЦ в целлюлозно-бумажной промышленности [6].
Процесс получения БЦ длительный и сложный, при этом выход целлюлозы низкий, что обусловлено биохимизмом процесса – для микроорганизмов-продуцентов синтез БЦ не является целевым. Изучение влияния различных условий культивирования продуцента на синтез БЦ проводится с целью повышения ее выхода. Основные параметры, влияющие на рост целлюлозосинтезирующих бактерий и образование БЦ – аэрация, температура культивирования, концентрация источника углерода, состав питательной среды, солнечный свет. Реакция микроорганизмов на эти факторы объясняется явлениями индукции и репрессии синтеза ферментов, в результате которых изменяется морфология клеток и их биосинтетическая способность [11].
Для каждого продуцента и конкретного штамма необходимо уточнять технологические параметры, основным из них является температура. Изучение влияния температуры на синтез БЦ продуцентом Acetobacter sp.A9 на среде Хестрима – Шреммана приведено в работе [13]. Для данного штамма оптимальной температурой для синтеза БЦ является 30 °С, снижение температуры культивирования до 25 °С несущественно снижает выход БЦ по сравнению с 30 °С, однако увеличение температуры культивирования до 35 °С значительно снижает выход БЦ. Температура культивирования влияет не только на выход, но и на физико-химические свойства БЦ, а именно строение и кристаллическую структуру. Установлено, что в образцах БЦ, синтезированных штаммом Acetobacter xylinum ATCC 23769, при температуре 4 °C преобладает триклинная модификация Ιβ [10], характерная для растительной целлюлозы [1]. При культивировании данного штамма при температуре 28 °C в образцах преобладает низкосимметричная метастабильная фаза Iα. Исследовано влияние температуры на выход БЦ, полученной с использованием продуцента Komagataebacter xylinum ATCC 53524 [12], и степень полимеризации полученных образцов БЦ. Структура полученных образцов БЦ исследована методом инфракрасной спектроскопии. Установлено, что для данного штамма оптимальной температурой для синтеза БЦ является 33 °С, температура не влияет на степень полимеризации полученных образцов БЦ, при культивировании при более высоких температурах в образцах БЦ преобладает триклинная модификация.
Ранее детально изучалось влияние температуры на рост и жизнедеятельность симбиотической культуры Мedusomyces gisevii [8]. Продуцент Мedusomyces gisevii представляет собой симбиотическую культуру, состоящую из 20–26 видов дрожжей и 8–10 уксуснокислых бактерий. Мedusomyces gisevii может использоваться как для синтеза БЦ [9], так и для получения освежающего, слегка газированного напитка [7]. Установлено, что оптимальной является температура в диапазоне 25–30 °С. В настоящее время изучено влияние озонирования на содержание этилового спирта в культуральной жидкости Мedusomyces gisevii при разных температурных режимах культивирования [3]. В данной работе не выявлено существенного влияния озона на количественные показатели этилового спирта, однако установлено, что при повышении температурных режимов его концентрация в питательной среде значительно снижается.
Целью данной работы является изучение влияния температуры на синтез БЦ продуцентом Мedusomyces gisevii и исследование структуры полученных образцов.
Материалы и методы исследования
В качестве инокулята использовалась семидневная культура, выращенная на синтетической глюкозной среде, доза внесения составляла 10 %. В экспериментах также использовалась синтетическая питательная среда, приготовленная растворением глюкозы в экстракте черного чая. Начальная концентрация субстрата составила 20 г/л, уровень активной кислотности саморегулировался симбиозом [2]. Культивирование проводилось в статических условиях при температурах от 21 до 36 °С с шагом 3 °С в течение 24 суток. Снижение концентрации глюкозы контролировалось спектрофотометрически (спектрофотометр «UNICOUV-2804», США) с использованием динитросалицилового реактива, уровень активной кислотности контролировался с помощью иономера (иономер И-160 МИ), прирост пленки БЦ оценивался гравиметрически (весы лабораторные аналитические Explorer EX-224).
Образцы пленок были очищены с помощью посуточного выдерживания в разбавленных растворах гидроксида натрия и соляной кислоты с последующим промыванием в дистиллированной воде до нейтральной реакции среды. Прозрачные гель-плёнки, высушивались на воздухе при комнатной температуре в расправленном состоянии.
В полученных образцах определена степень полимеризации по стандартной методике, которая основана на определении времени истечения из капиллярного вискозиметра разбавленных растворов целлюлозы и растворителя (кадоксена). Структура бактериальной целлюлозы была исследована на инфракрасном спектрофотометре «Инфралюм ФТ-801» в таблетках KBr.
Результаты исследования и их обсуждение
На рис. 1 представлена зависимость выхода БЦ от различных температурных режимов культивирования, на рис. 2 – зависимость выхода БЦ от температуры на 16-е сутки культивирования.
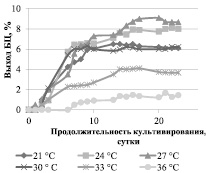
Рис. 1. Зависимость выхода БЦ от температуры культивирования
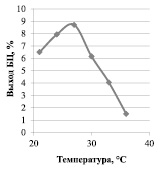
Рис. 2. Зависимость выхода БЦ от температуры на 16-е сутки культивирования
Рост гель-пленок БЦ происходит до 16 суток, далее наблюдается стационарная фаза и после 20-х суток – деградация БЦ. Температура от 24 до 27 °С наиболее благоприятна для синтеза БЦ, так как обеспечивает наибольший выход – 9 %. При температуре 30 °C и выше отмечается значительное снижение выхода БЦ: например при 36 °С выход составляет 1,5 %, что в 6 раз ниже, чем при 27 °С. Вероятно, при температуре выше 30 °C начинают происходить конформационные изменения ферментов, входящих в целлюлозосинтезирующий энзимный комплекс. Температура ниже 24 °С является недостаточной, так при 21 °С выход БЦ снижается и составляет 6,5 %, это явление может быть объяснено правилом Вант-Гоффа: при изменении температуры на каждые 10 градусов скорость большинства реакций изменяется в 2–4 раза.
В табл. 1 представлены данные по изменению концентрации редуцирующих веществ в процессе культивирования Мedusomyces gisevii при разных температурах.
Таблица 1
Снижение концентрации редуцирующих веществ при культивировании Мedusomyces gisevii
|
Температура, °С |
Продолжительность, сутки |
|||||||||||
|
0 |
1 |
2 |
3 |
6 |
7 |
10 |
13 |
15 |
17 |
20 |
24 |
|
|
21 |
20,0 |
20,0 |
16,2 |
12,8 |
4,9 |
3,8 |
1,7 |
1,7 |
1,7 |
1,7 |
1,7 |
1,7 |
|
24 |
20,0 |
20,0 |
16,4 |
12,0 |
3,2 |
2,2 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
1,0 |
|
27 |
20,0 |
20,0 |
15,4 |
10,0 |
3,2 |
1,8 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
1,5 |
|
30 |
20,0 |
18,9 |
12,2 |
8,4 |
3,1 |
2,1 |
1,4 |
1,4 |
1,4 |
1,4 |
1,4 |
1,4 |
|
33 |
20,0 |
19,8 |
12,0 |
6,0 |
3,1 |
2,0 |
1,1 |
1,1 |
1,1 |
1,1 |
1,1 |
1,1 |
|
36 |
20,0 |
18,8 |
13,1 |
3,0 |
1,5 |
1,3 |
1,3 |
1,3 |
1,3 |
1,3 |
1,3 |
1,3 |
В исследованном диапазоне температур скорость убыли редуцирующих веществ при культивировании Мedusomyces gisevii тем больше, чем выше температура, т.е. температурные оптимумы для утилизации субстрата и для синтеза БЦ не совпадают.
На рис. 3 представлено изменение уровня активной кислотности при культивировании Мedusomyces gisevii при разных температурах.
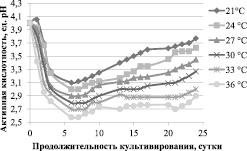
Рис. 3. Изменение уровня активной кислотности при культивировании Мedusomyces gisevii
Повышение температуры от 21 до 36 °С при культивировании симбиотической культуры Мedusomyces gisevii приводит к снижению уровня активной кислотности в обратно пропорциональной зависимости. Снижение уровня активной кислотности свидетельствует об образовании таких метаболитов, как уксусная, янтарная, глюконовая, молочная и яблочная кислоты [8]. Концентрация кислот возрастает прямо пропорционально повышению температуры культивирования в исследуемом диапазоне. Это не противоречит повышению скорости утилизации субстрата, таким образом, при повышении температуры выше 30 °С снижение выхода БЦ объяснено расходованием субстрата на биосинтез кислот.
Степень полимеризации образцов БЦ, синтезированных при различных температурах, на 10-е сутки культивирования, представлена в табл. 2.
Таблица 2
Степень полимеризации образцов бактериальной целлюлозы, синтезированных при различных температурах
|
Температура, °С |
21 |
24 |
27 |
30 |
33 |
36 |
|
Степень полимеризации |
2470 |
2880 |
2600 |
2200 |
2000 |
1390 |
Наибольшую степень полимеризации имеет образец, синтезированный при температуре 24 °C. При температурах выше 24 °С степень полимеризации снижается. Обнаруженная зависимость имеет нелинейный характер и сопоставима с зависимостью выхода БЦ от температуры. Таким образом, установлено, что условия культивирования влияют на свойства конечного продукта. Полученные данные раскрывают возможность контролировать процесс биосинтеза БЦ и получать материал с заданными свойствами.
Методом инфракрасной спектроскопии была установлена структура бактериальной целлюлозы. Сравнение полос поглощения функциональных групп в образцах бактериальной целлюлозы, полученных при различных температурах на 10-е сутки культивирования, представлено в табл. 3.
Таблица 3
Отнесение полос поглощения функциональных групп в образцах бактериальной целлюлозы
|
Отнесение полос поглощения* |
Максимум полосы поглощения, см-1 |
|||||
|
21 °С |
24 °С |
27 °С |
30 °С |
33 °С |
36 °С |
|
|
OH-групп, участвующих в межмолекулярных и внутримолекулярных H-связях |
3426 |
3424 |
3429 |
3419 |
3423 |
3354 |
|
связей в группах CH и CH2 |
2919 |
2918 |
2920 2854 |
2896 |
2896 |
2897 |
|
связей HOH обусловлено присутствием прочно связанной воды |
1654 |
1654 |
1654 1638 |
1654 1540 |
1639 1541 |
1631 |
|
групп CH2 |
1430 1373 |
1430 1373 |
1430 1375 |
1429 1372 |
1429 1372 |
1429 1371 |
|
групп OH в CH2OH |
– |
1320 |
– |
1337 1318 |
1337 1318 |
1337 1318 |
|
групп CH2 в CH2OH |
1282 1235 |
1282 1235 |
1282 1235 |
1281 1235 |
1281 1235 |
1281 1235 |
|
групп OH |
– |
1201 |
– |
1205 |
1204 |
1204 |
|
связей C-O (характерные для полисахаридов полосы, обусловленные наличием ацетильных связей C-O-C и связей С-О в спиртах) |
1060 |
1165 1059 |
1165 1060 |
1166 1113 1058 |
1166 1059 |
1164 1112 1060 |
|
-1,4 связи |
898 |
898 |
899 |
899 |
898 |
898 |
|
* – валентные колебания, – деформационные колебания, БЦ – бактериальная целлюлоза |
||||||
Интенсивная полоса 3200–3600 см-1 обусловлена валентными колебаниями OH-групп. Менее интенсивная полоса в области 2800–3000 см-1 обусловлена валентными колебаниями групп CH2, CH. Ряд полос различной интенсивности в диапазоне 2000–1500 см-1 – чувствителен к химическим и структурным превращениям. Полосы поглощения в области 1000–1200 см-1 обусловлены в основном валентными колебаниями C-O-C и C-O в спиртах. Полоса при 899 см-1 подтверждает наличие β-1,4 связей [14]. Спектральные характеристики образцов БЦ, синтезированных в исследуемом диапазоне температур, идентичны.
Выводы
Исследован биосинтез БЦ на синтетической глюкозной среде с использованием симбиотической культуры Мedusomyces gisevii в интервале температур от 21 до 36 °С. Установлено, что для синтеза БЦ культурой Мedusomyces gisevii оптимальным является температурный диапазон от 24 до 27 °С, отклонения от оптимума вызывают снижение целлюлозосинтетической способности. Отмечено, что температурные оптимумы для жизнедеятельности Мedusomyces gisevii и для биосинтеза БЦ не совпадают, повышение температуры культивирования приводит к интенсификации синтеза органических кислот. Установлено, степень полимеризации БЦ снижается обратно пропорционально повышению температуры культивирования. Показано, что инфракрасные спектры образцов БЦ, полученных в исследуемом диапазоне температур, идентичны.
Библиографическая ссылка
Гладышева Е.К. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА СИНТЕЗ БАКТЕРИАЛЬНОЙ ЦЕЛЛЮЛОЗЫ ПРОДУЦЕНТОМ МEDUSOMYCES GISEVII // Современные наукоемкие технологии. 2016. № 8-1. С. 36-40;URL: https://top-technologies.ru/ru/article/view?id=36098 (дата обращения: 05.03.2026).



