Питание, как процесс употребления пищи удовлетворяет самую насущную потребность человека, выступает необходимым условием существования людей, их общественной и трудовой деятельности. Общественное питание в своих коллективно организованных формах является важнейшим фактором и механизмом реализации социальной политики [7].
Целью работы являлось адаптировать спектрофотометрический метод для количественного определения α-аминокислот в зерновом сырье на основе исследования спектральных характеристик продуктов нингидроновой реакции.
Исходя из цели, были сформулированы следующие задачи:
– адаптировать метод спектрофотометрии и изучить спектральные характеристики в видимой и УФ-области оптической плотности водных растворов экстрактов зернового сырья;
– определить количественный состав заменимых и незаменимых аминокислот с применением 0,2 % раствора нингидрина;
– оптимизировать условия проведения кислотного гидролиза экстрактов образцов с целью повышения выхода суммы α-аминокислот из зернового сырья;
– изучить влияние продолжительности гидролиза на выход суммы α-аминокислот;
– изучить влияние балластных веществ на содержание суммы α-аминокислот в зерновом сырье после гидролиза (в оптимизированных условиях).
На начальном этапе эксперимента проводились исследования спектральных характеристик продуктов реакции α-аминокислот с 0,2 % раствором нингидрина в воде.
В качестве исследуемых образцов было подобрано зерновое сырье, выращенное в различных районах Республики Татарстан. Данные исследования проводились с целью выявления наиболее ценного зернового сырья в зависимости от географического места расположения, климатических условияй и метеорологических особенностей выращивания зерна. Кроме того, выявление генетических особенностей различных сортов зерна и влияние внешних условий при выращивании (одинаковые условия возделывания, дозы и соотношение удобрений, применение различных препаратов, условия, влияющие в значительной степени на биохимический состав). В работе рассмотрено 10 образцов со следующим обозначением: О-1; О-2; О-3; О-4; О-5; О-6; О-7; О-8; О-9 и О-10. Каждый образец отличается внешними признаками, формой, цветом, размером, а также районом выращивания и периодом созревания [8].
Изучение спектральных характеристик проводилось на спектрофотометре ПЭ-5300 ВИ в лаборатории биохимического анализа кафедры ТПП КНИТУ. Зерновое сырье (образцы) подверглось экстрагированию с получением водной эмульсии [1].
В результате исследования водных растворов образцов на спектрофотометре были получены следующие результаты в виде спектров поглощения оптической плотности (рис. 1).
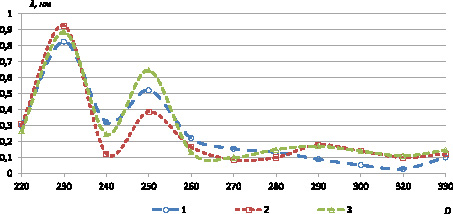
Рис. 1. УФ-область спектра продуктов взаимодействия экстракта зерновых культур с 0,2 % раствором нингидрина в воде: где D – оптическая плотность, λ – длина волны, нм
В результате эксперимента установлено, что для всех исследуемых образцов зерновых культур характерны четыре максимума поглощения, два из которых находятся в УФ-области, в интервале 220–240 и 250–260 нм, и два – в видимой области, в диапазоне 380–400 и 560–580 нм. Данная закономерность наблюдается для всех исследуемых образцов и объясняется наличием первичных аминогрупп α-аминокислот в структуре зернового сырья.
Таким образом, большинство продуктов реакции α-аминокислот с раствором нингидрина в воде характеризуется единым максимумом поглощения при длине волны 400 нм, что обусловливает целесообразность использования данной длины волны в качестве аналитической (табл. 1) [2].
Таблица 1
Характеристика спектров поглощения продуктов реакции α-аминокислот с 0,2 % раствором нингидрина
|
Максимум поглощения, нм |
Образец |
|||||||||
|
О-1 |
О-2 |
О-3 |
О-4 |
О-5 |
О-6 |
О-7 |
О-8 |
О-9 |
О-10 |
|
|
Видимая область |
400,56 |
400,56 |
400,47 |
399,56 |
400,53 |
400,65 |
400,65 |
400,56 |
400,78 |
400,49 |
|
УФ-область |
230,25 |
230,25 |
230,25 |
230,25 |
230,34 |
230,25 |
230,25 |
230,31 |
230,33 |
230,37 |
В работе [5] установлено, что водный раствор нингидрина имеет интенсивное поглощение в диапазоне длин волн 220 до 330 нм, но совершенно не поглощает в диапазоне длин волн 400–600 нм. Поэтому целесообразно проводить спектрофотометрические исследования продуктов реакции с 0,2 % водным раствором нингидрина в видимой области спектра.
Далее в работе было определено количественное содержание аминокислот в исследуемых образцах в соответствие с методикой [8]. Данная реакция впервые была открыта Руманом. Позднее установлено, что нингидрин специфичен к алифатическим или алициклическим первичным аминогруппам. Вторичные, третичные и четвертичные амины, амиды и амино-замещенные ароматические соединения дают слабую реакцию или не дают вовсе. Исключение – пролин, который образует с нингидрином окраску желтого цвета, как считают некоторые исследователи, благодаря раскрытию цикла.
Свободные α-аминокислоты дают сине-фиолетовое окрашивание с нингидрином. На первой стадии реакции α-аминокислот с нингидрином образуются углерода диоксид, альдегид и устойчивое промежуточное соединение 2-аминоиндандион, участвующий в двух параллельных реакциях. В одной из них он реагирует с нингидрином до образования 2-гидроксииндандиона и 2-иминоиндандиона, которые, конденсируясь между собой, формируют дикетогидринденкетогидринамин. Во второй реакции 2-аминоиндандион в кислой среде подвергается гидролизу до аммиака и 2-гидроксииндандиона, последний, взаимодействуя с нингидрином, образует гидриндантин.
Далее, проводились исследования спектральных характеристик образцов с 0,2 % водным раствором нингидрина после нагревания при температуре 100 °С в течение 15 мин. Для этого в исследуемых образцах, после проведения нингидриновой реакции, определяли оптимальные значения их оптических плотностей.
В водном извлечении зернового сырья аминокислоты содержатся как в свободном, так и в связанном состоянии (в составе пептидов и белков). С целью повышения выхода суммы аминокислот из зернового экстракта в работе были оптимизированы условия проведения кислотного гидролиза.
В качестве гидролизующего агента был использован раствор хлороводородной кислоты, обеспечивающий достаточно полное расщепление белков и пептидов водного экстракта до α-аминокислот. Кроме того, получаемые гидролизаты характеризуются высокой стабильностью, уменьшается вероятность их микробной контаминации, что является важным фактором при подготовке образцов к анализу.
На следующем этапе исследования был изучен аминокислотный состав зернового сырья после кислотного гидролиза. Следует отметить, что несмотря на высокий выход α-аминокислот, проведение кислотного гидролиза в данных условиях связано с воздействием повышенного давления на сырье, сложным аппаратурным оформлением процесса, а также со значительными временными затратами при подготовке гидролизата (более 20 ч), что ограничивает использование данной технологии в условиях промышленного производства. На этом основании целью являлось оптимизировать условия кислотного гидролиза для повышения выхода аминокислот из сырья и разработать доступную методику. К 5 г зернового сырья добавляли 35 мл воды и оставляли на 30 мин. Далее к сырью добавляли 65 мл раствора хлороводородной кислоты в концентрации от 0,5 М до 5 М и проводили гидролиз при температуре 80–90 °С в течении 2 ч. Затем гидролизат отделяли фильтрованием, а сырье для его более полного истощения четырехкратно экстрагировали водой (в соотношении 1:6) по 30 мин в аналогичном температурном режиме. Полученные извлечения фильтровали и объединяли с гидролизатом.
К объединенному гидролизату добавляли натрий гидрокарбонат до нейтральной реакции, переносили в мерную колбу вместимостью 250 мл и доводили водой до метки. В результате кислотного гидролиза образуется комплекс балластных веществ (в том числе и продукты частичного гидролиза ВМС), снижающих качество готового продукта. Для очистки от данных веществ, к 25 мл гидролизата добавляли трехкратный объем 96 % этанола и оставляли в течение 10–12 ч при температуре 3–4 °С. Образующийся осадок отделяли центрифугированием, после чего извлечение сгущали до полного удаления этанола, переносили в мерную колбу вместимостью 25 мл и доводили водой до метки.
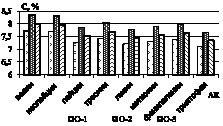
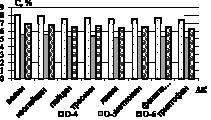
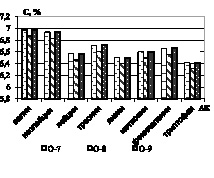
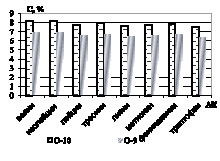
Далее проводилась нингидриновая реакция. Установлено, что гидролиз зернового сырья 1 М раствором хлороводородной кислоты обеспечивает наиболее высокий выход суммы аминокислот – до 0,94 % в пересчете на конкретную аминокислоту (рис. 2).
а) б)
в) г)
Рис. 2. Количественное содержание незаменимых α-аминокислот в образцах: а) образцы О-1; О-2; О-3; б) образцы О-4; О-5; О-6; в) образцы О-7; О-8; г) образцы О-9; О-10
Как видно из рисунков, количественное содержание незаменимых α-аминокислот в образцах незначительно варьируется, наиболее обогащенными можно выделить образцы О-2, О-4, и О-10, в которых количество незаменимых аминокислот на 20–30 % превышает остальные. Образец О-5 характеризуется наименьшими количественными характеристиками по всем незаменимым аминокислотам [3].
Анализ количественного содержания заменимых аминокислот показал следующие результаты: образцы О-1, О-2, О-4 и О-10 характеризуются наибольшим количественным содержанием заменимых аминокислот (8,91 %, 9,623 %, 9,228 % и 9,487 %), а образец О-5 с наименьшим (6,465 %).
Данные результаты позволяют определить наиболее ценные сорта зерна для использования в технологической линии производства отдельных видов сырья и продукции. Наиболее ценные по аминокислотному составу образцы рекомендуется использовать для приготовления продукции диетического и функционального назначения, а менее ценные образцы – на производство кондитерских и макаронных изделий.
В следующей части эксперимента было изучено влияние продолжительности гидролиза на выход суммы аминокислот.
Кислотный гидролиз, 1 М HCl, проводился в интервале времени 1, 3, 6 и 9 часов. Установлено, что наибольший выход суммы аминокислот из зернового сырья наблюдается при продолжительности гидролиза в течение 6 часов. На нейтрализацию полученного извлечения израсходовано 5 г натрия гидрокарбоната [4]. Данные по оптимизации условий проведения кислотного гидролиза зернового сырья приведены в табл. 2.
Таблица 2
Влияние регулируемых факторов кислотного гидролиза на выход суммы α-аминокислот зернового сырья
|
№ п/п |
Концентрация раствора HCl, М |
Время гидролиза, ч |
Выход суммы АК, % |
|
1 |
0,5 |
1 |
77,2 |
|
3 |
79,1 |
||
|
6 |
80,4 |
||
|
9 |
82,2 |
||
|
2 |
1,0 |
1 |
84,3 |
|
3 |
87,1 |
||
|
6 |
94,7 |
||
|
9 |
91,6 |
||
|
3 |
1,5 |
1 |
88,4 |
|
3 |
73,5 |
||
|
6 |
74,2 |
||
|
9 |
79,5 |
||
|
4 |
2,0 |
1 |
81,4 |
|
3 |
82,1 |
||
|
6 |
87,3 |
||
|
9 |
67,1 |
||
|
5 |
2,5 |
1 |
85,8 |
|
3 |
86,4 |
||
|
6 |
86,3 |
||
|
9 |
85,1 |
||
|
6 |
3,0 |
1 |
71,2 |
|
3 |
76,3 |
||
|
6 |
73,1 |
||
|
9 |
72,8 |
||
|
7 |
3,5 |
1 |
67,4 |
|
3 |
66,2 |
||
|
6 |
65,3 |
||
|
9 |
68,1 |
||
|
8 |
4,0 |
1 |
66,3 |
|
3 |
68,5 |
||
|
6 |
67,3 |
||
|
9 |
65,1 |
||
|
9 |
5,0 |
1 |
58,2 |
|
3 |
59,3 |
||
|
6 |
57,4 |
||
|
9 |
57,1 |
Таким образом, в работе оптимизированы условия кислотного гидролиза: к 5 г зернового сырья (точная навеска), высушенного до воздушно-сухого состояния, добавляли 35 мл воды дистиллированной и оставляли на 30 мин для набухания. Затем к набухшему сырью добавляли 65 мл 1 М раствора хлороводородной кислоты и проводили гидролиз при температуре 80–90 °С в интервале до 9 часов.
С целью изучения влияния балластных веществ на содержание суммы α-аминокислот в зерновом сырье после гидролиза (в оптимизированных условиях) были приготовлены кислотные гидролизаты без очистки и с очисткой от балластных веществ с последующим проведением нингидриновой реакции. Результаты представлены на примере незаменимой аминокислоты α-валин (рис. 3).
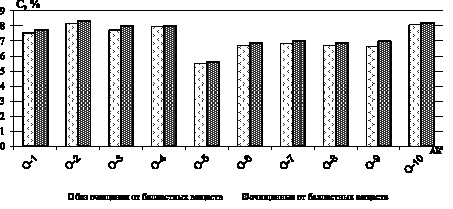
Рис. 3. Содержание незаменимых аминокислот в образцах с центрифугированием и без
По результатам диаграмм (по всем незаменимым аминокислотам) видно, что образцы подвергнувшиеся удалению балластных веществ методом центрифугирования, характеризуются содержанием незаменимых аминокислот на 1,5–2,7 % больше, чем в образцах без удаления балластных веществ. Так как исходное извлечение водного экстракта зернового сырья содержит вещества, реагирующие с нингидрином (а именно пептиды и белки), влияющие на изменение значений оптической плотности, может дать ошибку результат количественного содержания α-аминокислот. Поэтому для получения достоверных результатов, отражающих количественное содержание суммы α-аминокислот в растительном сырье, необходимо проводить доочистку от сопутствующих ВМС с помощью осаждения этанолом. Результаты количественного содержания суммы α-аминокислот в исследуемых образцах представлены в табл. 3.
Таблица 3
Суммарное содержание α-аминокислот в зерновом сырье
|
Образцы |
О-1 |
О-2 |
О-3 |
О-4 |
О-5 |
О-6 |
О-7 |
О-8 |
О-9 |
О-10 |
|
Содержание АК, % |
14,8 |
10,06 |
15,32 |
15,35 |
10,76 |
13,18 |
13,38 |
13,17 |
13,38 |
15,76 |
Статистическая обработка метода количественного определения суммы α-аминокислот в зерновом сырье характеризуется достаточно высокой точностью определения и воспроизводимостью. Относительная ошибка результатов определения для всех образцов не превышает ± 3 %.
В результате эксперимента были оптимизированы методы определения α-аминокислот в зерновом сырье, определены количественные характеристики незаменимых и заменимых аминокислот, а также определено их общее содержание с целью выявления образцов наиболее подходящих в технологии производства отдельных видов пищевого сырья [5].
Выводы
В работе проведена адаптация и оптимизация спектрофотометрического метода в количественном анализе суммы свободных α-аминокислот зернового сырья. На основе исследования спектральных характеристик продуктов нингидроновой реакции подобраны условия проведения биохимических исследований водных экстрактов образцов:
– исследованы спектральные характеристики продуктов реакции α-аминокислот с 0,2 % раствором нингидрина в видимой и УФ-области излучения;
– установлено, что, спектры поглощения в видимой области характеризуются наличием двух максимумов в диапазонах длин волн 380–400 и 560–580 нм, а также исследована УФ- область спектра поглощения продуктов реакции с 0,2 % раствором нингидрина, где установлено наличие двух максимумов в диапазонах длин волн 220–240 и 250–260 нм;
– определено, что большинство продуктов реакции α-аминокислот с раствором нингидрина в воде характеризуется единым максимумом поглощения при длине волны 400 нм, что обусловливает целесообразность использования данной длины волны в качестве основной аналитической;
– с целью повышения выхода суммы α-аминокислот из зернового экстракта были оптимизированы условия проведения кислотного гидролиза при использовании 1 М раствора хлороводородной кислоты;
– оптимизированные условия проведения кислотного гидролиза повысили выход α-аминокислот из сырья до максимального показателя 94,7 %;
– установлено, что наибольший выход суммы α-аминокислот из зернового сырья наблюдается при продолжительности гидролиза в течение 6 часов;
– определено, что удаление балластных веществ в образцах методом центрифугирования приводит к увеличению точности определения содержания незаменимых аминокислот на 1,5–2,7 %.
Библиографическая ссылка
Гумеров Т.Ю., Фахразиева З.Р., Федотов С.А. ПРИМЕНЕНИЕ СПЕКТРОФОТОМЕТРИЧЕСКОГО МЕТОДА АНАЛИЗА В КОЛИЧЕСТВЕННОМ ОПРЕДЕЛЕНИИ СУММЫ СВОБОДНЫХ ?-АМИНОКИСЛОТ // Современные наукоемкие технологии. 2015. № 12-2. С. 219-224;URL: https://top-technologies.ru/ru/article/view?id=35241 (дата обращения: 03.03.2026).



