Введение
Известно, что многие нейромедиаторы участвуют в формировании пищевого поведения, ощущений сытости и голода [1, 2]. При этом, медиаторы способны участвовать и в регуляции других вегетативных функций, обеспечивая сопряженную работу нервной и эндокринной систем. Изучая последствия пищевой депривации, особенно у лиц с первичным ожирением, важно иметь сведения об изменении состава медиаторного звена интерстициального сектора, окружающего клетки. Несомненно, что проведение РДТ сопровождается заметными нейроэндокринными перестройками, связанные с пищевой депривацией, психоэмоциональным напряжением, восстановлением работы желудочнокишечного тракта после депривации [4].Интегральная характеристика нейромедиаторного звена вегетативной регуляции важна для понимания процессов, происходящих в организме при проведении РДТ, и возможности проведения коррекции возникающих нарушений.
Материал и методы
Исследован нейромедиаторный состав интерстициального пространства и его изменение в динамике РДТ у 302 пациентов в возрасте от 20 до 71 года (мужчин 78, женщин 224 человека) с абдоминальным ожирением степени в сочетании с артериальной гипертонией стадии.
Все пациенты имели индекс массы тела более 30 кг/м2 [3]. Исследование гормонального состава интерстициального пространства методом соматометрии (соматограммы) осуществляли на аппарате DDFAO (Франция). Система и аппарат DDFAO рекомендованы Министерством Здравоохранения Российской Федерации (регистрационное удостоверение № 2003/990 от 07.07.2003) к использованию для диагностики и контроля проводимой терапии в различных медицинских учреждениях. Методика и аппарат регистрирует степень отклонения показателей ( «плюс» или «минус» в условных единицах ) от нормы. Метод соматометрии позволяет получить данные по содержанию в интерстициальном пространстве серотонина, дофамина, катехоламинов, ацетилхолина. Данные выражаются в условных единицах отклонения от нормы (знак «плюс» выше нормы; знак «минус» ниже нормы). Обследование проводили до начала курса и за 12 дня перед окончанием курса РДТ в период выхода из РДТ. Продолжительность курса РДТ составляла 1921 день; полная пищевая депривация от 7 до 15 дней. У больных регистрировали и рассчитывали: артериальное давление систолическое АДс, артериальное давление диастолическое АДд, среднее артериальное давление АДср. Всем пациентам проводился контроль массы тела по коэффициенту Кетле [ 3 ]. Пациенты были распределены на следующие возрастные группы: 2035 лет, 3660 лет, 61 год и более. Цифровой материал обработан по типовой программе «Statistiсa 5,0» с использованием критерия t Стьюдента. Различия принимались достоверными при р<0,05.
Результаты и их обсуждение
Курс РДТ оказался эффективным во всех возрастных группах, что подтверждалось достоверным уменьшением показателя индекса массы тела во всех возрастных группах (табл.1). К завершению курса РДТ со стороны системной гемодинамики отмечено достоверное снижение среднего артериального давления во всей исследуемой совокупности на 18,0% (р <0,01).
Анализ данных во всей исследуемой группе без распределения на возрастные группы показал, что достоверные изменения касались серотонина, дофамина и ацетилхолина (таблица 1). Содержание катехоламинов как до начала проведения РДТ, так и на «выходе» из него не изменялось.
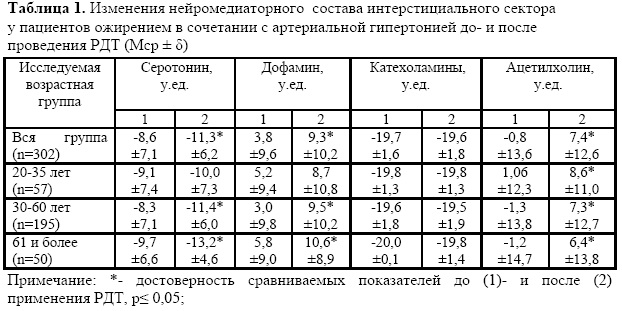
В возрастной группе 2035 лет происходили минимальные сдвиги, которые характеризовались значительным увеличением в содержании ацетилхолина после окончания лечебного голодания. По остальным исследуемым нейромедиаторам можно было отметить тенденцию к увеличению содержания дофамина в интерстициальном пространстве.
Наиболее выраженные сдвиги были отмечены в возрастной группе 3660 лет и 61 год и более. Эти изменения оказались однотипными в исследуемых возрастных группах и характеризовались снижением уровня серотонина и достоверным увеличением содержания дофамина и ацетилхолина. Концентрация катехоламинов до проведения РДТ и на выходе из него оставалась неизменной.
В возрастной группе 2035 лет происходили минимальные сдвиги, которые характеризовались значительным увеличением в содержании ацетилхолина после окончания лечебного голодания. По остальным исследуемым нейромедиаторам можно было отметить тенденцию к увеличению содержания дофамина в интерстициальном пространстве.
Наиболее выраженные сдвиги были отмечены в возрастной группе 3660 лет и 61 год и более. Эти изменения оказались однотипными в исследуемых возрастных группах и характеризовались снижением уровня серотонина и достоверным увеличением содержания дофамина и ацетилхолина. Концентрация катехоламинов до проведения РДТ и на выходе из него оставалась неизменной.
Выявленные изменения можно характеризовать как реакцию на мощный стрессорный фактор пищевую депривацию. Нейроэндокринные перестройки являются одним из звеньев функциональной системы пищевого поведения, направленного на ликвидацию чувства голода. С этих позиций можно объяснить активацию синтеза нейромедиаторов, повышающих чувство голода и аппетит. В частности, в наших наблюдениях достоверно повышался уровень дофамина, и напротив, снижался уровень серотонина. Известно, что дофамин стимулирует аппетит и активирует пищевое поведение, а серотонин и катехоламины подавляют это чувство [2]. Уменьшение серотонина, возможно, связано с возникновением относительного дефицита триптофана, как предшественника серотонина, в условиях лечебного голодания. Интересно отметить, что содержание катехоламинов не претерпевало существенных изменений. Это можно объяснить наступление адаптации и уменьшением стрессового воздействия пищевой депривации на выходе из РДТ.
Повышение уровня ацетилхолина в межклеточном секторе, по видимому, связано с восстановлением моторики и секреции желудочнокишечного тракта, что имеет важное адаптивное значение на этапе выхода из РДТ.
Сравнение полученных данных в возрастном аспекте показало, что в возрасте 2035 лет в ответ на пищевую депривацию происходят минимальные сдвиги в нейромедиаторном звене вегетативной регуляции, не выходящие за рамки компенсированных реакций. Можно сделать заключение о том, что в данном возрасте организм наиболее эффективно проявляет адаптивные возможности по отношению к голоду.
Выводы
1. В организме пациентов ожирением в сочетании с артериальной гипертонией в ответ на пищевую депривацию наблюдается изменения нейромедиаторного состава межклеточного сектора, характеризующиеся снижением уровня серотонина и увеличением дофамина и ацетилхолина.
2. Выраженность перестройки нейромедиаторного состава межклеточного сектора зависит от возраста пациента; наиболее эффективная адаптивная способность у пациентов с ожирением отмечена в возрасте 2035 лет.
СПИСОК ЛИТЕРАТУРЫ:
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Дифференциальная диагностика и лечение эндокринных заболеваний : руководство .М.: Медицина,2002 .752с.
2. Зайчик А.Ш., Чурилов Л.П.Основы патохимии. СПб.: ЭЛБИ,2000.С.470520.
3. Куркович Е.Ю. Обследование больных с избыточной массой тела//Натуральная фармакология и косметология.2006.№2.С.711.
4. Разгрузочнодиетическая терапия/ Под ред. А.Н. Кокосова. СПб.: СпецЛит, 2007. 320с.
Библиографическая ссылка
Уракова Т.Ю., Лысенков С.П., Даутов Ю.Ю., Лысенкова Н.С. НЕЙРОМЕДИАТОРНЫЙ СОСТАВ ИНТЕРСТИЦИАЛЬНОГО ПРОСТРАНСТВА У ПАЦИЕНТОВ ОЖИРЕНИЕМ В СОЧЕТАНИИ С АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ ПОД ДЕЙСТВИЕМ РАЗГРУЗОЧНОДИЕТИЧЕСКОЙ ТЕРАПИИ // Современные наукоемкие технологии. 2009. № 7. С. 11-14;URL: https://top-technologies.ru/ru/article/view?id=26489 (дата обращения: 05.02.2026).



