Данные о субклеточном распределении протеолитических ферментов и их белковых ингибиторов в тканях и органах насекомых крайне ограничены [9, 11, 19, 20, 21]. Исследование динамики активности пептидогидролаз и их белковых ингибиторов у насекомых в процессе их развития демонстрирует определяющую роль белковых ингибиторов протеиназ в регуляции протеолиза в онтогенезе насекомых [6]. Существенную информацию о функциональной роли белковых ингибиторов представляет изучение субклеточной локализации пептидогидролаз и их белковых ингибиторов.
В настоящей работе предпринято исследование субклеточной локализации пептидогидролаз и их белковых ингибиторов в грене тутового шелкопряда.
Изучение динамики активности пептидогидролаз и их белковых ингибиторов в грене тутового шелкопряда в процессе ее развития продемонстрировало определяющую роль белковых ингибиторов протеиназ в регуляции протеолиза в эмбриогенезе насекомого [7]. Существенную информацию о функциональной роли белковых ингибиторов в эмбриональном развитии тутового шелкопряда представляет изучение их субклеточной локализации.
Полученные результаты, характеризующие распределение активности исследованных протеиназ и их белковых ингибиторов с оптимумом рН 3,0; 3,6; 6,2; 7,2; 8,6 и 9,0 по субклеточным фракциям грены (рис. 1, 2), показали существенные различия в уровне активности протеолитических ферментов и их белковых ингибиторов между отдельными субклеточными фракциями яиц тутового шелкопряда, что свидетельствует о разнообразии функций, выполняемых ферментами и их ингибиторами в каждой из субклеточных cтруктур.
Максимальный уровень протеолитической активности исследованных аспартильных, кислых и слабокислых цистеиновых протеиназ (оптимум рН 3,0; 3,6 и 6,2), основной функцией которых является деградация запасных белков, главным образом характерен для лизосомальной фракции грены. Существенно меньший уровень активности обнаружен для ядерной и митохондриальной фракций грены (рис. 1). В литературе имеются сведения о наличии лизосомальных цистеиновых и аспартильных протеиназ в яйцах насекомых [1, 10, 16]. Существуют данные о нахождении цистеиновых протеиназ в ядерной и митохондриальной фракциях животных клеток [3, 4]. Присутствие пептидогидролаз в ядрах насекомых является достаточно хорошо установленным фактом [4].
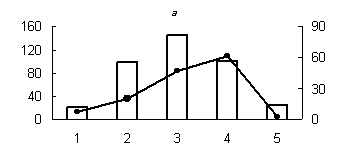
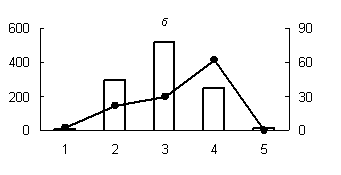
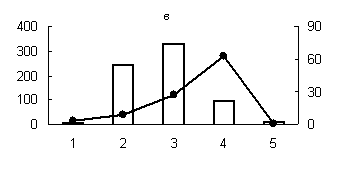
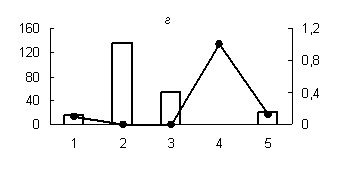
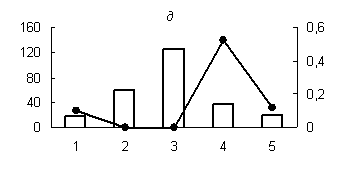
Рис. 1. Распределение активности пепсиноподобных (а) (оптимум рН - 3,0), цистеиновых протеиназ (оптимум рН: (б) - 3,0; (в) - 3,6; (г) - 6,2; (д) - 8,6) и их белковых ингибиторов по субклеточным фракциям грены тутового шелкопряда.
Здесь и на рис. 2: Линия - протеолитическая активность; столбики - активность ингибиторов. По оси ординат: слева - активность ингибиторов, справа - протеолитическая активность (усл. ед / мг белка); по оси абсцисс - субклеточные фракции: 1 - исходный гомогенат, 2 - ядерная фракция, 3 - митохондриальная фракция, 4 - лизосомальная фракция, 5 - постлизосомальная фракция.
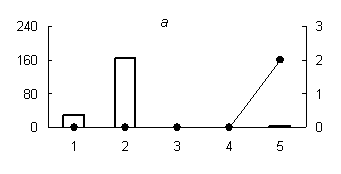
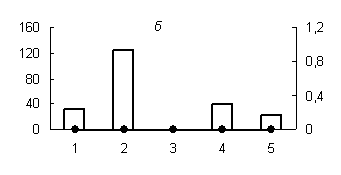
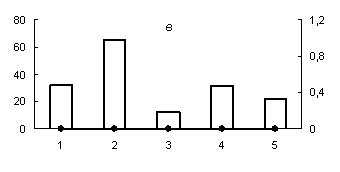
Рис. 2. Распределение активности химотрипсиноподобных (а) (оптимум рН 7,2), трипсиноподобных протеиназ (оптимум рН: (б) - 6,2; (в) - 9,0) и их белковых ингибиторов по субклеточным фракциям грены тутового шелкопряда.
Согласно литературным данным [9, 10], лизосомальные цистеиновые и аспартильные протеиназы (катепсино-B-подобные, катепсино-L-подобные и катепсино-D-подобные протеиназы) участвуют в расщеплении запасных белков (вителлин) в эмбриогенезе насекомых.
Наличие высокой активности аспартильных и цистеиновых протеиназ в митохондриальной фракции не является неожиданным фактом (рис. 1). Активность цистеиновых протеиназ была обнаружена в митохондриях желточных клеток артемии [13] и в митохондриях ооцитов сиговых рыб [2].
В последнее время появились сообщения о том, что митохондрии играют ключевую роль в апоптозе. Так, белок с молекулярной массой 50 кДа, являясь цистеиновой протеиназой, локализованной в митохондриях, в бесклеточной системе изолированных ядер вызывает конденсацию хроматина и межнуклеосомную фрагментацию ДНК, то есть индуцирует апоптоз [3].
В отличие от аспартильных и цистеиновых протеиназ, активность сериновых протеаз не обнаружена в субклеточных фракциях грены 4 дня постдиапаузного развития (рис. 2, б, в), так как их основная активность приходится на конец эмбрионального развития насекомого. Исключение составляют лишь химотрипсиноподобные протеиназы (оптимум рН 7,2), активность которых обнаружена в постлизосомальной фракции (рис. 2, а).
Существенно и то, что белковые ингибиторы кислых пептидогидролаз локализованы в тех же компартментах грены, что и протеолитические ферменты. При этом уровень активности белковых ингибиторов во всех случаях дополнителен по отношению к активности соответствующего энзима (рис.1), что доказывает наличие функциональной связи между ними.
Известно, что в ядрах насекомых и млекопитающих обнаружены комплексы протеаза-ингибитор. Такие комплексы описаны для цистеиновых протеиназ (каспаз). Цистеиновая протеиназа связывается ковалентно с ингибитором через дисульфидную связь [3]. Резкое преобладание активности белковых ингибиторов аспартильных, цистеиновых и сериновых протеиназ в ядерной фракции грены (рис. 1, 2); свидетельствует на наш взгляд, о возможном участии ингибиторов пептидогидролаз в поддержании структуры и целостности ядер, т. к. протеолитическое расщепление их структурных и функциональных белков приводит к нарушению структурной организации органелл, к разбалансировке упорядоченных биохимических реакций в них и в итоге к фрагментации ДНК и гибели клеток.
Таким образом, ядерные белковые ингибиторы протеаз грены тутового шелкопряда, возможно, принимают участие в регуляции механизмов процесса клеточной гибели (апоптоза).
Наличие высокой активности белковых ингибиторов цистеиновых и аспартильных протеиназ в митохондриальной фракции (рис. 1), по-видимому, связано с присутствием в этом компартменте соответствующих протеиназ и с защитой структурных и функциональных белков от протеолитического действия этих энзимов.
Локализация белковых ингибиторов протеиназ в лизосомальной фракции свидетельствует об участии этих белков в процессах регуляции гидролиза запасных белков желтка в ходе эмбрионального развития тутового шелкопряда. Так, высокий уровень активности пептидогидролаз в лизосомах, участвующих в деградации запасных белков, объясняется незначительной активностью белковых ингибиторов протеиназ в этих субклеточных структурах.
Таким образом, приведенные выше экспериментальные данные о субклеточной локализации цистеиновых, аспартильных и сериновых протеиназ и их белковых ингибиторов в грене тутового шелкопряда; позволяют заключить, что основная функция белковых ингибиторов пептидогидролаз, состоящая в регуляции активности эндогенных протеиназ, реализуется в грене при осуществлении различных процессов, и, в том числе при защите внутриклеточных структурных и функциональных белков ядер и митохондрий от повреждающего действия протеиназ.
СПИСОК ЛИТЕРАТУРЫ:
- Иванов В.Г. Белковый комплекс и протеолитические ферменты желточного содержимого грены тутового шелкопряда Bombyx mori L.: Автореф. дисс. ... канд. биол. наук. - М.: МПГИ, 1985. 14 с.
- Коновалов Ю.Д. // Успехи соврем. биологии. - 1986. - Т. 101. № 3. С. 359-373.
- Куцый Н. П., Кузнецова Е. А., Газиев А. И. // Биохимия. - 1999. - Т. 64. № 2. С. 149-163.
- Назаров А.Ю. Характеристика протеолитического комплекса ферментов хроматина тутового шелкопряда Bomyx mori L.: Автореф. дисс. ... канд. биол. наук. - М.: МПГУ, 1993. 14 с.
- Немова Н. Н. Внутриклеточные протеолитические ферменты у рыб. - Петрозаводск: КНЦ РАН, 1996. 104 с.
- Ярыгин Д.В. Изучение комплекса протеолитических ферментов и их белковых ингибиторов в грене тутового шелкопряда: Автореф. дисс. ... канд. биол. наук. - М.: МПГУ, 2000. 16 с.
- Ярыгин Д.В., Клунова С.М., Филиппович Ю.Б. // Онтогенез. - 2001. - Т. 32. № 4. С. 269-276.
- Chapman H. A., Riese R. I., Shi G. P. // Ann. Rev. Physiol. - 1997. - V. 59. P. 63-88.
- Cho W. L., Tsao S. M., Hays A. R., Walter R., Chen J. S., Shigirevskaya E. S., Raikhel A. S. // J. Biol. Chem. - 1999. - V. 274. №. 19. P. 13311-13321.
- Dittmer N. T., Raikhel A. S. // Insect Biochem. Molec. Biol. - 1997. - V. 27. №. 4. P. 323-335.
- Gan H., Wang Y., Jang H.B., Mita K., Kanost M.R. // Insect Biochem. and Molec. Biol. - 2001. - V.31. № 9. P. 887-898.
- Gburek J., Osada J., Siekierka M., Warwas M. // Compar. Biochem. Physiol. B. - 1995. - V. 112. №. 4. P. 697-701.
- Lu J., Warner A. H. // Biochem. Cell Biol. - 1991. - V. 69. №. 2-3. P. 96-101.
- Ohshita T., Kido H. // Anal. Biochem. - 1995. - V. 230. №. 1. P. 41-47.
- Spiess E., Bruning A., Gack S., Ulbricht B., Spring H., Trefz G., Ebert T. // J. Histochem. Cytochem. - 1994. - V. 42. №. 7. P. 917-929.
- Takahashi S.Y., Yamamoto Y., Shionoya Y., Kageyama T. // J. Biochem. - 1993. - V. 114. № 2. P. 267-272.
- Vasilev A. V., Gutkin D. V., Dankova T. G., Vorobeichik T. A., Tutelyan V. A. // Voprosy meditsinskoi khimii. - 1991. - V. 37. №. 6. P. 89-91.
- Wakayama T., Iseki Sh. // Acta Histochem. Cytochem. - 1997. - V. 30. №. 5-6. P. 557-565.
- Yamahama Y., Uto N., Tamotsu S., Miyata T., Yamamoto Y., Watabe S., Takahashi S.Y. // J. Insect Physiol. - 2003. - V. 49. №. 2. P. 131-140.
- Yang X.M., Hou L.J., Dong D.J., Shao H.L., Wang J.H., Zhao X.F. // Arch. Insect Вiochem. Physiol. - 2006. - V. 62. № 1. P.1-10.
- Zhao X.F., An X.M, Wang J.H., Dong D.J., Du X.J., Sueda S., Kondo H. // Arch. Insect biochem. Physiol. - 2005. - V. 58. № 1. P.39-46.
- Zhivotovsky B., Nicotera P., Orrenius S. // Cell Proliferat. - 1995. - V. 28. №. 4. P. 172.
Библиографическая ссылка
Ярыгин Д.В., Крылова И.Д., Коничев А.С., Филиппович Ю.Б. ИССЛЕДОВАНИЕ ВНУТРИКЛЕТОЧНОЙ ЛОКАЛИЗАЦИИ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ И ИХ БЕЛКОВЫХ ИНГИБИТОРОВ В ГРЕНЕ ТУТОВОГО ШЕЛКОПРЯДА // Современные наукоемкие технологии. 2008. № 9. С. 11-15;URL: https://top-technologies.ru/ru/article/view?id=24180 (дата обращения: 08.01.2026).



