СПИСОК ЛИТЕРАТУРЫ:
- Горелик М.В. Химия антрахинонов и их производных. - М.: Химия, 1983.- 296 с.
- Денисов В.Я. Химия промежуточных продуктов антрахинонового ряда. В 2-х частях.- Кемерово: КемГУ, 1987-1988.- Ч. 1.- 79 с.- Ч.2.- 65 с.
- Elseviers Encyclopaedia of organic chemistry/ Ed. E.Josephy, F.Radt.- N.Y.-Amsterdam: Elsevier, 1946.-V. 13, ser. 3.- P. 444, 466.
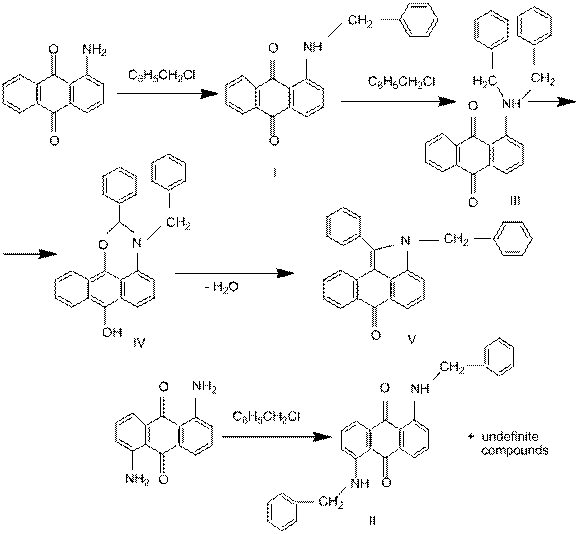
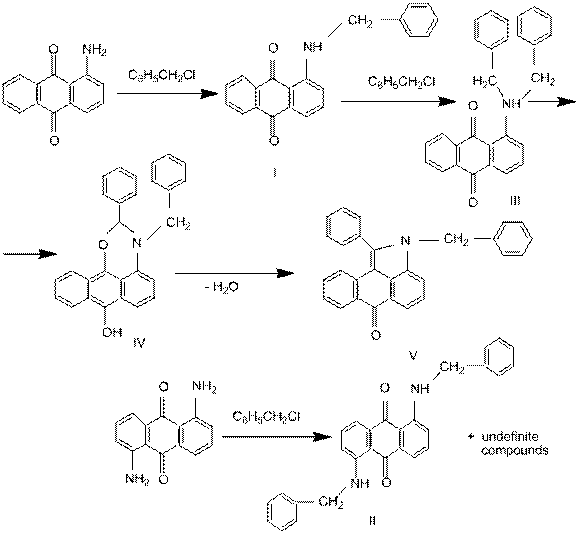
- Денисов В.Я., Фокин Е.П., Анишина Л.Н. Термолиз 1-диалкиламиноантрахинонов - новый путь синтеза производных антра[1,9-bc]пиррола// Хим. гетероциклич. соедин.1975.-№ 10.- С. 1360-1363.
Библиографическая ссылка
Денисов В.Я., Попов С.Ю. СИНТЕЗ ЛЮМИНОФОРОВ НА ОСНОВЕ 1-АМИНОАНТРАХИНОНА // Современные наукоемкие технологии. 2008. № 4. С. 138-140;URL: https://top-technologies.ru/ru/article/view?id=23793 (дата обращения: 07.03.2026).



