В данной работе рассмотрена возможность очистки воды путем инициирования цепных реакций с помощью гидроксильных радикалов. Для этого на берегу водоема предполагается установить генератор холодной плазмы, вырабатывающий озоно-гидроксильную смесь. Загрязненная вода забирается с помощью насоса из водоема, обрабатывается озоно-гидроксиль-ной смесью и сбрасывается обратно в водоем. Такая обработка за длительное время позволяет окислить от 20 до 40% органических примесей. Оставшиеся примеси могут легче окисляться в естественных условиях.

Рис. 1. Блок-схема эксперимента. 1 - генератор холодной плазмы; 2 - эжектор; 3 - бассейн с обрабатываемой жидкостью; 4 - водяной насос.
Экспериментальная часть Установка для инициирования цепной реакции окисления органических примесей в воде представлена на рисунке.
Активные частицы (радикалы и озон) вырабатывались в генераторе под действием холодной плазмы [1]. В этом генераторе между электродами и поверхностью воды зажигался вспышечный коронный электрический разряд. Под действием разряда в парах воды образовывались радикалы и озон. Радикалы, взаимодействуя с озоном, превращаются из одного вида в другой: ![]() , сами радикалы не гибнут, на поддержание их «жизни» расходуется озон. Поэтому озоно-гидроксильная смесь может транспортироваться за пределы реактора [1]. Радикалы, образующиеся в области электрического разряда, уносятся из реактора потоком воздуха, всасываемого эжектором. В эжекторе жидкость смешивается с высасываемым из генератора газом, содержащим активные частицы, и после этого сбрасывается обратно в водоём. Эксперименты выполнены для бассейнов объемом 12 л; 40; 8х103 и 5х106 л. Использовался генератор с числом электродов 144, током разряда 10 мА. На электроды подавалось высокое напряжение - 11 кВ.
, сами радикалы не гибнут, на поддержание их «жизни» расходуется озон. Поэтому озоно-гидроксильная смесь может транспортироваться за пределы реактора [1]. Радикалы, образующиеся в области электрического разряда, уносятся из реактора потоком воздуха, всасываемого эжектором. В эжекторе жидкость смешивается с высасываемым из генератора газом, содержащим активные частицы, и после этого сбрасывается обратно в водоём. Эксперименты выполнены для бассейнов объемом 12 л; 40; 8х103 и 5х106 л. Использовался генератор с числом электродов 144, током разряда 10 мА. На электроды подавалось высокое напряжение - 11 кВ.
Производительность генератора радикалов определяется суммарным током электрического разряда. Выход радикалов ОН· равен 32 моль/(моль электронов) или 32 радикала на один прошедший в цепи электрон [6]. Для генератора с током разряда 10 мА (мощностью 110 Вт) выход радикалов составляет N0 ~ 3,4х10-6 моль/с. Эффективность вывода радикалов, полученная экспериментально, ~ 1/3. Полный выход активных частиц (радикалы + озон) при разряде на воздухе составляет 150 моль/(моль электронов), однако озон не инициирует цепных реакций и в данном случае не играет решающей роли. Озон нужен в первую очередь для того, чтобы вывести радикалы из реактора. Практически все выведенные из генератора радикалы ОН·, взаимодействуя с органическим веществом, образуют новые радикалы R·, поэтому полагаем, что [R·] = [OH·].
В эжекторе жидкость смешивается с воздухом в соотношении 1:1. Максимальная концентрация кислорода в воде при комнатной температуре составляет 2х10-4 моль/л (~ 7 мг/л). Сильно загрязненная вода, поступающая на вход эжектора, полностью лишена кислорода. За короткое время контакта пузырьков воздуха с водой часть кислорода может диффундировать в воду. Для дальнейших оценок величину средней концентрации кислорода в воде принимаем равной [O2] ~ 3х10-6 моль/л.
Результаты и обсуждение
Для экспериментов использовалась фенольная сточная вода коксохимического производства, основными органическими компонентами которой являются фенолы и минеральные масла. Начальное значение химического поглощения кислорода ХПК = 2000 мг О/л. ХПК измеряли стандартным методом путем кипячения пробы в кислой среде с бихроматом калия и последующим титрованием солью Мора.
Результаты экспериментов для объёмов обрабатываемой жидкости 12 л; 40; 8х103 и 5х106 л приведены в таблице.
Таблица 1. Скорость окисления органических примесей и концентрация радикалов в воде при разных объемах замкнутого бассейна. Средняя концентрация кислорода в воде принята равной 3 10-6 моль/л
|
Объём бассейна, л |
DХПК за 1 час во всём объёме, г О/ч |
Концентрация радикалов, моль/л (расчёт) |
|
|
эксперимент |
расчёт |
||
|
12 |
1 ± 0,5 |
0,63 |
9,4х10-8 |
|
40 |
2,5 ± 0,5 |
2,1 |
5,1х10-8 |
|
8х103 |
20 ± 10 |
16,3 |
3,6х10-9 |
|
5х106 |
500 ± 200 |
408 |
1,4х10-10 |
|
109 |
- |
5770 |
1х10-11 |
Окисление органических примесей в воде происходит по цепному механизму, поэтому оценка скорости окисления и концентрации радикалов в воде сделана на основе схемы цепного окисления [7]. Для случая, когда окисление инициируется гидроксильными радикалами, схема процесса выглядит следующим образом (здесь R· - органический радикал).
Инициирование
OH· + RH → R· + H2O k1 ~ 109 - 1010 л/(моль. с) (1)
Продолжение цепи
R· + O2 → ROO· k2 ~ 107 - 108 л/(моль с) (2)
ROO· + RH → ROOH + R· k3 ~ 2,5 104 -1,4 106 л/(моль с) (3)
Разветвление цепи
ROOH → RO· + OH· k4 ~ (0,5 - 3,25) 10-6 (4)
Обрыв цепи
R· + R· → .... (5)
R· + ROO· → .... (6)
ROO· + ROO· → .... (7)
В реакциях 5 - 7 образуются неактивные продукты, k5 - k7 ~ 106 л/(моль с).
Ингибирование процесса
R· + XH → X· + RH (8)
Процесс сильно замедляется, если вторичный радикал X·, образующийся в реакции (8), окажется малоактивным. В малом объеме (~ 100 мл) и при постоянном воздействии окислителей (радикалов ОН, генерируемых в электрическом разряде при наличии паров воды) вторично образовавшиеся радикалы будут взаимодействовать между собой (реакции 5 - 7), либо с радикалами-окислителями (ОН·), и цепной процесс не наблюдается [5]. Однако с увеличением объема системы концентрация вторично образовавшихся радикалов становится мала и вероятность гибели радикалов сильно уменьшается.
Скорость процесса цепного окисления определяется скоростью реакций (2 - 3) и зависит от концентрации радикалов. Лимитирующей стадией цепного процесса является реакция (2), так как скорость поступления кислорода в воду ограничена, а концентрация исходного органического вещества в сильно загрязненной воде всегда велика. В процессе окисления радикалы не гибнут, их число сохраняется. Радикалы гибнут в реакциях рекомбинации (5 - 7) и становятся малоактивными, переставая давать заметный вклад, после реакции (8).
Рассмотрим условия протекания цепной реакции в замкнутом водоеме (в пруду). Оценим концентрацию радикалов в обрабатываемом объеме при установлении стационарного состояния. Как упоминалось выше, эффективность вывода радикалов из генератора составляет ~ 1/3 [1]. Производительность генератора радикалов N0. Расходуются радикалы в реакциях обрыва цепи (5 - 7) и реакциях (8), продуктами которых являются малоактивные радикалы. Скорость реакции (8) может намного превышать скорость реакции обрыва цепи (5 -7). Предположим, что она в 10 раз превышает скорость гибели радикалов при взаимодействии их между собой (реакции 5 - 7). Для численных оценок примем, что w5 = w6 = w7, а w8 = 10w5. Тогда уравнение баланса радикалов при стационарном состоянии в бассейне объемом V примет вид:
![]()
откуда
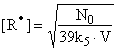 (9)
(9)
Оценим теперь скорость окисления в единице объёма:
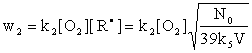 (10)
(10)
Во всём объёме ΔХПК = w2×V. Учтём, что выход активных частиц пропорционален току электрического разряда I, N0 ~ I. Экспериментально установлено, что эффективная длина цепи в объёме жидкости 12 л составляет 2,7. Опираясь на эту цифру, была получена полуэмпирическая зависимость скорости окисления, или уменьшения ХПК во всём объёме жидкости, от тока разряда генератора и объёма обрабатываемой жидкости:
ΔХПК (мг О/ч) = ![]() (11)
(11)
По формулам (9) и (11) получены расчётные значения концентрации радикалов и скорости уменьшения ХПК во всём объёме жидкости, приведённые в таблице. Предполагалось, что пруд мелкий, так как насыщение грязной воды кислородом за счет естественных процессов происходит на глубину порядка 1 м [8]. При концентрации радикалов 10-11 моль/л и содержании кислорода в воде 3×10-6 моль/л скорость окисления во всём пруду объёмом 109 л составит ΔХПК = 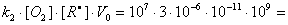 0,3 моль О/с, что соответствует 35 кг О/ч. Концентрация кислорода в воде была взята на уровне 1% от максимально возможной. Если концентрацию кислорода удастся сделать больше - скорость окисления возрастет.
0,3 моль О/с, что соответствует 35 кг О/ч. Концентрация кислорода в воде была взята на уровне 1% от максимально возможной. Если концентрацию кислорода удастся сделать больше - скорость окисления возрастет.
Из таблицы видно, что расчётная концентрация радикалов в воде большого водоёма (106 - 109 - литров) составляет 10-10 - 10-11 моль/л, что того же порядка, как и в морской воде под действием солнца (10-10 - 10-11 моль/л) [4]. Так как в средних широтах солнечных дней немного, скорость окисления под действием активных частиц, вырабатываемых генератором мощностью 110 Вт, может превосходить скорость естественных процессов.
Степень окисления сложных органических соединений зависит от их состава. В случае фенола [5] при непродолжительной обработке (часы) степень окисления фенола при объеме обрабатываемой жидкости порядка десятков литров и концентрации фенола около 1 г/л невелика (5 - 10%). Спектрофотометрически идентифицировано образование гидрохинона. При более длительной обработке образуются карбоновые кислоты, рН фенольной сточной воды за сутки уменьшается от 7,5 до 5. При этом наблюдалось уменьшение ХПК до 20%. При окислении до карбоновых кислот ХПК может уменьшится на ~ 40%.
В случае хорошего насыщения воды кислородом фенол окисляется до углекислого газа и воды [5, 2]. При этом через воду в бассейне продували чистый кислород и реакция протекала в среде кислорода. Эксперимент, выполненный в бассейне объемом 40 л на воздухе показал, что при недостатке кислорода (без дополнительного продува воздуха через жидкость в бассейне) фенол и ему подобные органические соединения полимеризуются, образуя каменноугольные смолы большой молекулярной массы, обладающие малой токсичностью, плохо растворимые в воде и выпадающие в осадок.
Вывод
Рассмотрена возможность использования цепных радикальных реакций для очистки воды в больших объемах жидкости. Генератор холодной плазмы, вырабатывающий озоно-гидроксильную смесь, смонтированный на берегу водоема (пруда, озера) и работающий непрерывно, может при малом расходе энергии существенно улучшить степень чистоты воды, достижимую под действием естественных процессов.
СПИСОК ЛИТЕРАТУРЫ:- Аристова Н.А., Пискарев И.М. Генерирование озоно-гидроксильной смеси в коронном электрическом разряде. // Журнал физической химии. 2003. Т. 77. №5. с. 813 - 816.
- Аристова Н.А., Пискарев И.М. Окисление фенола под действием электрического разряда. // Химия и технология воды. 2001. Т. 23. № 5. С. 510 - 519.
- Кисленко В.Н., Берлин Ад. А. Кинетика и механизм окисления органических веществ пероксидом водорода. // Успехи химии. 1991. Т. 60. Вып. 5. С. 949 - 981.
- Штамм Е.В., Пурмаль А.П., Скурлатов Ю.И. Роль пероксида водорода в природной водной среде. // Успехи химии. 1991. Т. 60. Вып. 11. С. 2373 - 2411.
- Пискарев И.М. Окисление фенола частицами ОН· , Н и О3, образующимися в электрическом разряде. // Кинетика и катализ. 1999. Т. 40. № 4. с. 505 - 511.
- Пискарев И.М. Модель реакций при коронном разряде в системе O2(г) - Н2О. // Журнал физической химии. 2000. Т. 74. №3. с. 546 - 551.
- Эмануэль Н.М., Денисов Е.Т., Майзус З.К. Цепные реакции окисления углеводородов в жидкой фазе. М.: Наука. 1965.
- K. Cameron, C. Madramootoo, A. Crolla, C. Kinsley. Pollutant removal from municipal sewage lagoon effluents with a free-surface wetland. // Water Research. 2003. V. 37. № 12. P. 2803 - 2812.
Библиографическая ссылка
Аристова Н.А., Пискарев И.М. ОЧИСТКА ВОДЫ В БОЛЬШИХ ВОДОЕМАХ ЗА СЧЕТ ЦЕПНЫХ РЕАКЦИЙ, ИНИЦИИРОВАННЫХ ГИДРОКСИЛЬНЫМИ РАДИКАЛАМИ // Современные наукоемкие технологии. 2008. № 2. С. 42-46;URL: https://top-technologies.ru/ru/article/view?id=23133 (дата обращения: 13.02.2026).



