Дизайн и молекулярное конструирование биологически активных молекул связаны с использованием различных подходов и методов. К одному из таких подходов молекулярного конструирования можно отнести исследование влияния изменения компонентов структуры на биологическую активность, зашифрованное при моделировании в структурных параметрах (дескрипторах) регрессионным анализом. Благодаря изучению зависимостей «структура-активность» можно проводить разработку активностных биологических моделей, основанных на дескрипторах различного уровня: квантово-химических, физико-химических и др. При моделировании биологической активности (БА), основываясь только на прогнозируемых значениях биологической активности, при экспериментальном подтверждении точность разработанных моделей зависимостей будет невысокой. Для целей успешного молекулярного дизайна и последующего виртуального скрининга, представляло интерес проведение многоуровневого исследования, основанного на сочетании значений биологической активности, экспериментальных и прогнозируемых.
Моделирование БА автором проводилось на примере производных антраниловой кислоты с широким спектром биологического действия: противовоспалительного [1–3], анальгетического [4] и противомикробного [5, 6].
Цель работы заключается в изучении способа многоуровневого математического моделирования анальгетической активности в дизайне алгоритмов количественных зависимостей «структура-активность» соединений ряда производных антраниловой кислоты.
Материалы и методы исследования
При расчете суммарных структурных дескрипторов использована программа Gaussian 03 с полуэмпирическим методом РМ3 (Parametric Method 3). В качестве структурных дескрипторов, при исследовании методом корреляционного анализа по анальгетической активности, использованы суммарные квантово-химические дескрипторы по атомам углерода (∑С), кислорода (∑O) и водорода (∑H). Многоуровневое моделирование биологических активностей выполняли на основе регрессионных уравнений программой Statistica 6.
Результаты исследования и их обсуждение
Для моделирования анальгетической активности (АА) предложен способ многоуровневого математического моделирования в разработке способа дизайна алгоритмов имитационных моделей биологической активности.
Перед проведением исследований в области дизайна модели «структура – анальгетическая активность» рассчитаны прогнозируемые значения АА с помощью ранее полученной программы AK_QSAR (АА) [7], которая основана на экспериментальных данных АА.
Объектом исследования являются производные антраниловой кислоты, под общим химическим названием ряда амиды и гидразиды N–замещенных антраниловых кислот. Общая химическая структура объекта исследования приведена на рисунке.
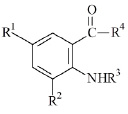
Общая химическая структура соединений ряда амиды и гидразиды N–замещенных антраниловых кислот с заместителями: R1, R2, R3, R4
С использованием программы AK_QSAR (АА) проведено молекулярное конструирование 30 соединений (1–30), общей химической структуры (рисунок):
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NHNH2 (1);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH2 (2);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH CH3 (3);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH CH2CH2OH (4);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH С6H11 (циклогексил) (5);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH CH2C6H5 (6);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH NHCO CH3 (7);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH NHCO CH2C6H5 (8);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH NHCO C6H5 (9);
R1 = Br, R2 = H, R3 = COCH2C6H5, R4 = NH NHCO 2-фурил (10);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NHNH2 (11);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH2 (12);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH CH3 (13);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH CH2CH2OH (14);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH С6H11 (циклогексил) (15);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH CH2C6H5 (16);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH NHCO CH3 (17);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH NHCO CH2C6H5 (18);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH NHCO C6H5 (19);
R1 = Br, R2 = Br, R3 = COCH2C6H5, R4 = NH NHCO 2-фурил (20);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NHNH2 (21);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH2 (22);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH CH3 (23);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH CH2CH2OH (24);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH С6H11 (циклогексил) (25);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH CH2C6H5 (26);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH NHCO CH3 (27);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH NHCO CH2C6H5 (28);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH NHCO C6H5 (29);
R1 = Cl, R2 = Cl, R3 = COCH2C6H5, R4 = NH NHCO 2-фурил (30).
Способ многоуровневого математического моделирования состоит из четырех стадий:
1 стадия. Проверка совместимости экспериментальных значений БА с прогнозируемыми, полученными молекулярным конструированием программой AK_QSAR.
2 стадия. Отбор значимых дескрипторов корреляционным анализом с БА и объема выборки.
3 стадия. Формирование моделей и множественный линейный регрессионный анализ.
4 стадия. Отбор модели прогноза БА, по точности прогнозирования анализируемого ряда производных.
При проведении исследования на 1 стадии использованы результаты молекулярного конструирования 10 производных антраниловой кислоты с анальгетической активностью (АА) (соединения 1–10) (табл. 1).
Первая стадия содержит экспериментальные и расчетные данные БА, в которой проводится регрессионная оценка пригодности прогнозируемых значений анальгетической активности для исследований «структура-активность». Для проведения тестирования использована выборка из девяти (31–39) ранее опубликованных результатов экспериментальных данных анальгетической активности в ряду амидов и гидразидов N–замещенных антраниловых кислот по АА [8], общей химической структуры (рисунок):
R1 = H, R2 = H, R3 = CO CONHCH2CH = CH2, R4 = NH CH2CH(CH3)2 (31);
R1 = Br, R2 = Br, R3 = CO CH3, R4 = NH CH3 (32);
R1 = Br, R2 = Br, R3 = CO CH3, R4 = NH CH2CH2OH (33);
R1 = Br, R2 = Br, R3 = CO CH3, R4 = NH CH2C6H5 (34);
R1 = H, R2 = H, R3 = CO адамантил, R4 = NH CH2CH = CH2 (35);
R1 = H, R2 = H, R3 = CO CONHCH2CH = CH2, R4 = NH (CH2)2CH(CH3)2 (36);
R1 = H, R2 = H, R3 = CO COOC2H5, R4 = NH CH2CH = CH2 (37);
R1 = Br, R2 = Br, R3 = CO CH3, R4 = NHNH2 (38);
R1 = Br, R2 = Br, R3 = CO CH3, R4 = NH (CH2)2CH(CH3)2 (39).
В результате проведенного регрессионного тестирования зависимости «структура – анальгетическая активность» от квантово-химических дескрипторов всего было составлено свыше 15 уравнений множественной регрессии, из которых было отобрано одно наиболее значимое:
ААрассч. = 15,809 + 0,087 × ∑H (пот) – 0,405 × ∑O (пот) –
1,765 ×∑С (E) + 16,376 ×∑С (|q|) – 0,368 × ∑H (E)
(R = 0,864; F = 7,72; S = 2,986; p<0,0014; N = 19) (табл. 1).
Таблица 1
Прогнозируемые (ААрассч.) и экспериментальные (ААэксп.) значения АА, квантово-химические дескрипторы напряженности, потенциала и заряда в модуле соединений 1–10, 31–39
|
№ |
ААрассч., с |
ААэксп., с |
∑С(E) |
∑O(E) |
∑H(E) |
∑С(Пот) |
∑O(Пот) |
∑H(Пот) |
∑С(|q|) |
∑O(|q|) |
∑H(|q|) |
|
1 |
23,61 |
– |
11,263 |
2,069 |
15,863 |
257,748 |
36,084 |
143,655 |
1,941 |
0,910 |
1,503 |
|
2 |
18,83 |
– |
10,840 |
1,763 |
15,351 |
242,557 |
28,730 |
132,963 |
1,891 |
0,701 |
1,478 |
|
3 |
21,05 |
– |
10,971 |
1,918 |
17,918 |
251,736 |
33,267 |
152,249 |
2,015 |
0,716 |
1,559 |
|
4 |
17,18 |
– |
11,618 |
2,530 |
18,753 |
266,812 |
46,331 |
165,323 |
2,036 |
0,713 |
1,567 |
|
5 |
25,86 |
– |
12,724 |
1,940 |
19,727 |
296,352 |
33,825 |
174,320 |
2,189 |
0,754 |
1,726 |
|
6 |
29,56 |
– |
14,600 |
1,951 |
20,497 |
334,851 |
34,117 |
233,769 |
2,403 |
0,707 |
1,926 |
|
7 |
15,54 |
– |
11,325 |
2,532 |
18,156 |
264,179 |
45,821 |
163,442 |
1,990 |
0,888 |
1,548 |
|
8 |
24,05 |
– |
14,954 |
2,566 |
20,735 |
347,293 |
46,671 |
244,962 |
2,378 |
0,879 |
1,915 |
|
9 |
15,14 |
– |
12,083 |
2,549 |
19,906 |
281,112 |
46,209 |
174,577 |
2,098 |
0,885 |
1,656 |
|
10 |
12,21 |
– |
11,050 |
2,917 |
18,066 |
255,025 |
54,118 |
151,628 |
2,024 |
0,910 |
1,561 |
|
31 |
– |
27,00 |
12,007 |
2,445 |
21,258 |
293,458 |
42,039 |
234,756 |
2,144 |
0,978 |
1,767 |
|
32 |
– |
21,40 |
5,721 |
1,809 |
11,497 |
131,015 |
30,635 |
86,670 |
1,436 |
0,711 |
0,967 |
|
33 |
– |
19,00 |
6,369 |
2,420 |
12,332 |
146,091 |
43,699 |
99,744 |
1,457 |
0,708 |
0,975 |
|
34 |
– |
27,40 |
9,351 |
1,842 |
14,076 |
214,129 |
31,485 |
168,190 |
1,824 |
0,702 |
1,334 |
|
35 |
– |
27,00 |
14,300 |
1,957 |
30,925 |
325,015 |
34,525 |
270,012 |
2,267 |
0,675 |
1,968 |
|
36 |
– |
28,00 |
10,309 |
2,445 |
22,419 |
255,301 |
41,913 |
229,518 |
2,186 |
0,919 |
1,816 |
|
37 |
– |
24,00 |
7,290 |
1,993 |
15,289 |
180,658 |
36,826 |
114,926 |
1,827 |
0,797 |
1,329 |
|
38 |
– |
16,40 |
6,014 |
1,960 |
9,442 |
137,027 |
33,452 |
78,075 |
1,362 |
0,905 |
0,911 |
|
39 |
– |
20,00 |
8,465 |
1,845 |
15,905 |
207,188 |
31,400 |
171,752 |
1,762 |
0,678 |
1,292 |
Полученные результаты регрессионного тестирования модели БА «структура-активность» на независимой выборке экспериментальных результатов АА из 9 соединений, показывают совместимость экспериментальных результатов с прогнозируемыми, при уровне значимости (p) равном 0,0014 (p < 0,05), и имеют высокое значение коэффициента множественной регрессии (R = 0,864).
2 стадия. Отбор значимых дескрипторов корреляционным анализом с БА и объема выборки.
При проведении корреляционного анализа по анальгетической активности использованы суммарные квантово-химические дескрипторы по атомам углерода (∑С), кислорода (∑O) и водорода (∑H) (табл. 2).
По результатам корреляционного анализа, приведенного во второй стадии, проведен отбор квантово-химических дескрипторов пяти уровней выборок: 10 соединений, 15 соединений, 20 соединений, 25 соединений и 30 соединений. Отбор дескрипторов осуществлен по критериям: коэффициент корреляции (R > 0,500) и критерий Фишера (F> 6).
Таблица 2
Прогнозируемые (ААрассч.) значения АА и квантово-химические дескрипторы напряженности, потенциала и заряда в модуле соединений 11–30
|
№ |
АА рассч., с |
∑С(E) |
∑O(E) |
∑H(E) |
∑С(Пот) |
∑O(Пот) |
∑H(Пот) |
∑С(|q|) |
∑O(|q|) |
∑H(|q|) |
|
11 |
20,69 |
10,994 |
2,056 |
15,073 |
250,339 |
35,777 |
138,523 |
1,858 |
0,912 |
1,372 |
|
12 |
15,91 |
10,571 |
1,750 |
14,561 |
235,148 |
28,422 |
127,831 |
1,807 |
0,703 |
1,347 |
|
13 |
18,13 |
10,702 |
1,905 |
17,128 |
244,327 |
32,960 |
147,117 |
1,931 |
0,719 |
1,428 |
|
14 |
14,26 |
11,349 |
2,517 |
17,963 |
259,403 |
46,024 |
160,191 |
1,953 |
0,715 |
1,436 |
|
15 |
22,95 |
12,455 |
1,928 |
18,937 |
288,943 |
33,518 |
169,188 |
2,106 |
0,756 |
1,595 |
|
16 |
26,64 |
14,331 |
1,939 |
19,707 |
327,442 |
33,810 |
228,637 |
2,320 |
0,709 |
1,795 |
|
17 |
12,62 |
11,056 |
2,520 |
17,366 |
256,770 |
45,513 |
158,310 |
1,906 |
0,890 |
1,417 |
|
18 |
21,13 |
14,685 |
2,553 |
19,945 |
339,884 |
46,363 |
239,830 |
2,295 |
0,881 |
1,784 |
|
19 |
12,22 |
11,814 |
2,536 |
19,116 |
273,703 |
45,902 |
169,445 |
2,014 |
0,888 |
1,525 |
|
20 |
9,30 |
10,781 |
2,904 |
17,276 |
247,617 |
53,811 |
146,496 |
1,941 |
0,912 |
1,430 |
|
21 |
20,69 |
10,994 |
2,056 |
15,073 |
250,339 |
35,777 |
138,523 |
1,858 |
0,912 |
1,372 |
|
22 |
15,91 |
10,571 |
1,750 |
14,561 |
235,148 |
28,422 |
127,831 |
1,807 |
0,703 |
1,347 |
|
23 |
18,13 |
10,702 |
1,905 |
17,128 |
244,327 |
32,960 |
147,117 |
1,931 |
0,719 |
1,428 |
|
24 |
14,26 |
11,349 |
2,517 |
17,963 |
259,403 |
46,024 |
160,191 |
1,953 |
0,715 |
1,436 |
|
25 |
22,95 |
12,455 |
1,928 |
18,937 |
288,943 |
33,518 |
169,188 |
2,106 |
0,756 |
1,595 |
|
26 |
26,64 |
14,331 |
1,939 |
19,707 |
327,442 |
33,810 |
228,637 |
2,320 |
0,709 |
1,795 |
|
27 |
12,62 |
11,056 |
2,520 |
17,366 |
256,770 |
45,513 |
158,310 |
1,906 |
0,890 |
1,417 |
|
28 |
21,13 |
14,685 |
2,553 |
19,945 |
339,884 |
46,363 |
239,830 |
2,295 |
0,881 |
1,784 |
|
29 |
12,22 |
11,814 |
2,536 |
19,116 |
273,703 |
45,902 |
169,445 |
2,014 |
0,888 |
1,525 |
|
30 |
20,00 |
8,465 |
1,845 |
15,905 |
207,188 |
31,400 |
171,752 |
1,762 |
0,678 |
1,292 |
3 стадия. Формирование моделей по объему выборки на основе корреляционного анализа и множественный линейный регрессионный анализ.
С использованием результатов корреляционного анализа, выделено пять суммарных моделей (№ 1–5), основанные на объеме выборки по критериям: значения коэффициента корреляции (R > 0,500) и критерия Фишера (F> 6):
1 модель (N = 10 соединений): ∑C (E), ∑O (E).
2 модель (N = 15 соединений): ∑C (E), ∑С (пот), ∑C (|q|), ∑H (|q|).
3 модель (N = 20 соединений): ∑C (E), ∑O (E), ∑C (пот), ∑O (пот), ∑Н (пот), ∑C (|q|), ∑H (|q|).
4 модель (N = 25 соединений): ∑C (E), ∑O (E), ∑C (пот), ∑O (пот), ∑Н (пот), ∑C (|q|), ∑H (|q|).
5 модель (N = 30 соединений): ∑C (E), ∑O (E), ∑C (пот), ∑O (пот), ∑Н (пот), ∑C (|q|), ∑H (|q|).
Дополнительно проведен анализ двух моделей № 6 и № 7, при значении коэффициента корреляции (R > 0,500), а критерия Фишера меньше 6:
6 модель (N = 10 соединений): ∑C (пот), ∑O (пот), ∑Н (пот), ∑C (|q|), ∑H (|q|).
7 модель (N = 15 соединений): ∑O (E), ∑H (пот).
С использованием выделенных семи суммарных моделей, методом множественного линейного регрессионного анализа, пошаговым исключением дескрипторов по одному, получено 18 уравнений множественной регрессии.
По результатам регрессионного анализа проведен отбор значимых моделей с коэффициентом корреляции (R): 0,700 и более и значением критерия Фишера (F): 10 и более.
В результате осуществлен отбор 5 уравнений регрессии, которые отвечают заданным критериям (табл. 3).
4 стадия. Отбор модели прогноза БА, по точности прогнозирования анализируемого ряда производных.
Таблица 3
Результаты проверки уравнений регрессии связи АА со структурой в ряду амидов и гидразидов N–замещенных антраниловых кислот на независимой выборке из 9 соединений (31–39)
|
№ |
Уравнение регрессии |
Оценка прогноза АА |
|
|
Rпрогн. |
Sпрогн. |
||
|
1 |
ААрассч. = 11,872 + 2,449 × ∑С (E) – 9,372 × ∑О (E) (R = 0,942; F = 27,85; S = 2,07; N = 10) |
0,693 |
10,43 |
|
14 |
ААрассч. = –20,611 + 0,298 × ∑С (пот) – 0,549 × ∑O (пот) – – 0,045 × ∑H (пот) + 122,199 × ∑C (|q|) – 163,366 × ∑H(|q|) (R = 0,981; F = 20,038; S = 1,606; N = 10) |
0,511 |
16,89 |
|
16 |
ААрассч. = 1,879 + 0,167 × ∑С (пот) – 0,436 × ∑O (пот) – 0,061 × ∑H (пот) (R = 0,941; F = 15,575; S = 2,258; N = 10) |
0,728 |
12,96 |
|
17 |
ААрассч. = 9,317 + 0,105× ∑С (пот) – 0,447 × ∑O (пот) (R = 0,939; F = 25,868; S = 2,139; N = 10) |
0,740 |
9,63 |
|
18 |
ААрассч. = 22,335 – 9,424 × ∑O(E) + 0,109 × ∑H (пот) (R = 0,881; F = 20,893; S = 2,479; N = 15) |
0,749 |
5,64 |
Выполнена оценка полученных регрессионных уравнений № 1, 14, 16, 17 и 18 прогнозированием анальгетической активности на независимой выборке из 9 производных антраниловой кислоты, с экспериментальными результатами АА (АА эксп., с). Дескрипторы, используемые при расчетах АА соединений 31–39, приведены в табл. 1.
Выполнена оценка теоретического расчета АА с использованием величины коэффициента корреляции прогнозируемых значений АА с экспериментальными (Rпрогн.), и значений средней квадратичной ошибки прогноза (Sпрогн.) (табл. 3).
Заключение
В результате проведенного исследования по дизайну модели «структура – анальгетическая активность» получено 5 уравнений множественной регрессии.
Проведена оценка найденных уравнений прогнозированием АА на независимой выборке из девяти соединений, в результате выбрано уравнение № 18. Уравнение 18 (двухпараметровое) имеет минимальную Sпрогн. равную 5,64, прогноза АА, среди найденных уравнений. По коэффициенту корреляции, наиболее статистически значимым по результатам прогнозирования, является уравнение 18 с максимальным Rпрогн. равным 0,749, в сравнении с остальными полученными уравнениями.
Полученные результаты многоуровневого математического моделирования показывают его практическую пригодность и целенаправленность при проведении дизайна уравнений «структура-активность» с использованием теоретических значений БА в ряду производных антраниловой кислоты.



