Оптическая когерентная томография (ОКТ) – это быстро развивающаяся методика медицинской визуализации, активно внедряемая в клиническую практику. Основываясь на принципах низкокогерентной интерферометрии, ОКТ используется в офтальмологии, где рассеивание света в исследуемых слоях ткани сравнительно низкое, и, следовательно, интерпретация изображения относительно проста. И наоборот, интерпретация изображений ОКТ в большинстве других тканей часто страдает от смешанного вклада рассеяния зондирующего излучения в ткани. Помимо размытия структурных особенностей ткани на изображениях ОКТ, сильное рассеяние приводит к интенсивному перекрытию интерференционных картин, создаваемых зондирующими фотонами с одинаковой длиной оптического пути. Это явление проявляется через пеструю структуру изображения ОКТ, что способствует сложности интерпретации изображения. Таким образом, спекл-структура изображения ОКТ определяется оптическими свойствами отображаемого образца, а именно локальным распределением коэффициента обратного отражения [1]. Теоретические возможности систем ОКТ при изучении рассеивающих структур могут быть проверены путем соответствующего анализа [2].
Цель работы: дифференцирование отражённых и малократно рассеянных назад фотонов при увеличении глубины когерентного зондирования (ГКЗ) посредством построения матрицы дисперсий.
При увеличении глубины залегания структур исследуемого образца получение его достоверного структурного изображения при помощи ОКТ затруднено в связи с появлением спекл-шумов, многократным рассеиванием оптического излучения, особенностями применяемого источника излучения и особенностями сканирования в плече образца. Для совершенствования технических особенностей методики, лежащих в основе взаимодействия оптического излучения с биологическими тканями и лучшего представления структур тканей необходимо увеличение глубины когерентного зондирования (ГКЗ) [3].
Решение поставленной задачи сводится к определению средних изменений свойств рассеивателей исследуемого биообъекта, использующих локальные вариации интенсивности пикселей изображения ОКТ. Соответствующие количественные и метрические методы использовались для выявления различий структурных и функциональных изображений in vivo [4]. Пространственное изменение структуры спеклов и пикселей возможно количественно определять путем расчета матрицы дисперсий между последовательными В-сканами или соседними А-сканами увеличенного изображения.
Материалы и методы исследования
В настоящем эксперименте использовался ОКТ на базе интерферометра Майкельсона, использующий малоугловое растровое сканирование в плече образца для уменьшения спекл-шума и увеличении отношения С/Ш. Подобный подход даёт возможность увеличить ГКЗ на 20–30 % [3].
Основными объектами для исследования выступали поверхностные слои кожи человека с подкожными кровеносными сосудами in vivo. Для исследования было взято изображение – результат сложения 900 А-сканов (рис. 1, слева). На рисунке отчетливо виден роговой слой эпидермиса, различимы границы структур фасции и стенки кровеносного сосуда. Изображение содержит подкожный кровеносный сосуд диаметром ~1 мм, визуализируемый до глубины 1,3–1,8 мм.
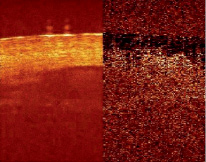
Рис. 1. Структурное ОКТ изображение кожи, сосуда и крови человека in vivo (слева) и изображение матрицы дисперсий (справа). Усреднение проведено по 5 соответствующим пикселям; размер изображения 2×2 мм
Оптические характеристики ткани и сосудов сильно различаются, а, следовательно, им соответствует различная интенсивность пикселей конечного изображения [4], что выражается разностью между соседними А-сканами изображения. Для проверки данной гипотезы были рассчитаны дисперсии интенсивности соответствующих пикселей изображения.
Дисперсия была рассчитана по стандартной формуле
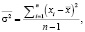
изначально, n было взято равное 5. А-скан исходного изображения и дисперсия для пяти соседних сканов представлена на рис. 2.
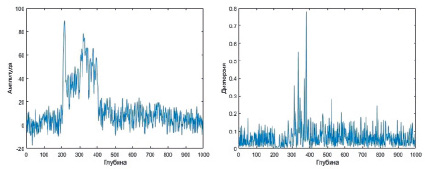
Рис. 2. А-скан кровеносного сосуда человека (слева); и дисперсия пяти соседних сканов (справа)
На полученном графике выделение отдельных областей затруднено, в связи с равномерным распределением дисперсии по структурным областям, как следствие эффектов рассеивания, отражения и спекл-шумов [5]. Для более объективной оценки изображения на основе полученных данных были построены матрицы дисперсий для исходного изображения и изображений усредненных по 2–10 соседним сканам. Результаты второй части матрицы дисперсии приведены на рис. 3, слева.
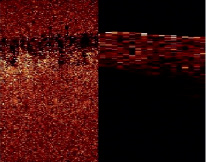
Рис 3. Матрица дисперсии исходного структурного изображения (слева); и изображения усредненного по пяти соседним А-сканам (справа)
Полученная матрица дисперсий для исходного изображения отличается высокой пространственной интенсивностью, что затрудняет выявление структурных областей. Для минимизации шумов и артефактов, оказывающих влияние на результаты построения матрицы дисперсии, произведено усреднение по соседним А-сканам изображения.
Матрица дисперсии структурного ОКТ-изображения, усредненного по пяти соседним А-сканам представлена на рис. 3, справа. Отмечается значительное уменьшение интенсивности в области воздуха, области кровеносного сосуда и области ниже реализуемой глубины когерентного зондирования. Область кожных покровов, в свою очередь, обладает наибольшей интенсивностью на матрице дисперсий. Это объясняется тем, что ткани, обладающие наименьшими показателями анизотропии g и наибольшими коэффициентами рассеяния μs, отличаются наибольшими интенсивностями изображения. В то же время ткани с высоким показателем коэффициента анизотропии, в которых сравнительно небольшая часть фотонов отражается назад, имеют относительно небольшую интенсивность на структурном изображении [6, 7].
Для количественного представления результатов эксперимента была построена зависимость отношения сигнал/шум от количества усреднений, а также проанализированы средние значения интенсивности области кожных покровов, воздуха и сосудов в зависимости от количества усреднений ОКТ-изображения (рис. 4).
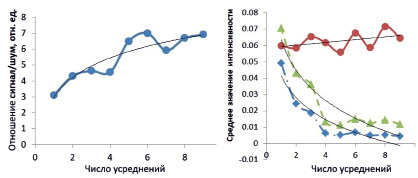
Рис. 4. График зависимости отношения сигнал/шум от числа усреднений (слева); график среднего значения интенсивности для области кожи (сплошная красная линия), воздуха (синяя штрихпунктирная линия) и крови (зелёная пунктирная линия) от числа усреднений (справа)
График зависимости отношения сигнал/шум от числа усреднений аппроксимирован логарифмической зависимостью (R2 = 0,85), наблюдается логарифмическое увеличение без асимптотического насыщения [8]. Как следствие, увеличения отношения сигнал/шум происходит логарифмический спад интенсивности матрицы дисперсии областей кровеносного сосуда и воздуха (R2 = 0,9). Однако область кожных покровов матрицы дисперсий остается практически неизменной по количеству усреднения и аппроксимируется линейно (R2 = 0,75). Подобные расчёты проведены при вычислении дисперсий по 2–10 соседним А-сканам. Во всех областях наблюдается логарифмический спад интенсивности, кроме области кожных покровов, соответствующий линейной зависимости.
Результаты исследования и их обсуждение
Матрицы дисперсий, полученные в ходе обработки изображений, представляют собой отраженные и малократно рассеянные фотоны в процессе построения структурного изображения в оптической когерентной томографии. Под малократным рассеянием в данном контексте подразумевается рассеяние назад, которому предшествовало относительно небольшое количество событий рассеяния. В отличие от отраженных фотонов, которые несут максимум информации о строении исследуемого биообъекта, малократно рассеянные фотоны с увеличением числа событий взаимодействия с тканью предшествовавших детектированию несут все меньше полезного сигнала. Такой подход объясняет падение пространственного разрешения на ОКТ-изображениях с глубиной и создает предпосылки для разработки эффективных методов идентификации потоков биологических жидкостей в толще исследуемой ткани. Сложная пространственная структура потока, в сочетании с ее флуктуациями во времени, теоретически должны приводить к изменениям в траекториях фотонов из области внутрисосудистого пространства, в частности к увеличению кратности рассеяния, что можно наблюдать при помощи построения матрицы дисперсий.
На представленной матрице дисперсий (рис. 3, слева), выделение границ между различными структурами затруднено в связи с высокой общей интенсивностью, что отчетливо видно на рис. 4. Высокая дисперсия связана с наличием спекл-шума на исходном изображении, поэтому для его минимизации использован метод усреднения изображения по соседним А-сканам при малоугловом сканировании.
Изображение, усредненное по пяти соседним А-сканам, имеет большую величину отношения сигнал/шум (рис. 4) и отличается от исходного меньшим влиянием спекл-шумов. На матрице дисперсий данного изображения (рис. 3), яркость пикселей областей воздуха, кровеносного сосуда и области ниже глубины когерентного зондирования минимальная. В свою очередь, область кожных покровов имеет наибольшие показатели дисперсии. Это объясняется минимальным влиянием спекл-шума, оптическими свойствами ткани и рассеянием (отражением).
Также были проведены расчеты дисперсий по 2–10 А-сканам, результаты полученных зависимостей практически не отличаются, наблюдается логарифмический спад интенсивностей областей сосуда и воздуха и линейная зависимость для области кожных покровов.
Недостатком представленного метода является уменьшение пространственного разрешения получаемого изображения, как следствие расчета дисперсии, что мешает высокоточному позиционированию меняющихся структур. Уменьшение или увеличение количества анализируемых пикселей уменьшают общую контрастность матрицы дисперсий и уменьшают адекватность анализа изображения. Для решения этой проблемы и дальнейшего построения структурных и функциональных анатомических карт предлагается использовать матрицу дисперсий совместно с дифференцированием структур кожи, сосудов и крови при помощи анализа распределения гистограммы интенсивности пикселей [9].
Таким образом, построение матрицы дисперсий структурных ОКТ изображений (В-сканов) позволяет производить моделирование влияния отраженных и малократно рассеянных назад фотонов, демонстрирует возможность дифференциации различных типов структурных изображений in vivo, обладает потенциалом для увеличения ГКЗ и визуализации глубоких структур глубоких слоёв тканей. Представленный метод предназначен для проведения биофизических экспериментов по изучению оптического просветления, компенсации рассеяния, компрессионных воздействий на биологические ткани, исследование знакопеременных потоков крови, минимизации спекл-шума и дифференциации различных более глубоких структур биообъектов in vivo.
Выводы
В настоящей работе описаны результаты исследования, в котором при помощи цифровой обработки были построены структурные ОКТ изображения слоёв кожи и кровеносного сосуда человека in vivo. Также были получены матрицы дисперсий, отражающие процессы обратного рассеяния и отражения когерентных фотонов. Выявлено, что при низких значениях отношения сигнал/шум расчет разности между пикселями пяти последовательных изображений отражает артефакты построения томографического изображения, такие как спекл-шум, отражение и рассеяние. При больших значениях отношения сигнал/шум влияние шумовых компонент минимально, а вычисление дисперсии позволяет обнаруживать изменения гетерогенности среды, например слоёв кожи и кровеносного сосуда.
Дальнейшие исследования будут связаны с обработкой 2D и 3D изображений ОКТ, а также созданием автоматизированного программного комплекса, основанного на результатах приведённых вычислений. Развитие этого алгоритма совместно с дифференцированием структур кожи, сосудов и крови при помощи анализа распределения гистограммы интенсивности пикселей позволит создать анатомические карты подкожных кровеносных сосудов человека и животных in vivo.



