Природные воды Тюменской области отличаются повышенным содержанием нефтепродуктов, марганца, цинка, меди, соединений железа [1]. Вода с содержанием железа от 1,5 мг/л и больше окрашена в желто-бурый цвет. Такая вода имеет повышенную мутность, металлический привкус и поэтому не может быть пригодна для питья Содержание железа по СанПиН не должно превышать величину 0,3 мг/л [2]. Бытовая и промышленная техника может выйти из строя даже при меньшем содержании железа в результате образования хлопъеобразного осадка в системе водоснабжения. Избыточное содержание железа приводит к негативному воздействию на кожу человека, влияет на состав крови, ведет к возникновению аллергических реакций, могут быть поражены внутренние органы человека [3]. В связи с этим весьма актуальной является проблема избыточного содержания железа в источниках централизованного водоснабжения населения питьевой водой.
Результаты исследования процесса сорбции ионов железа (III) на природных сорбентах монтмориллоните и каолините, проведенного в статических условиях при температурах 298, 318 и 333 К, представлены в работе [4]. Известно, что сорбционную активность неорганических сорбентов можно повысить путем их химической обработки [5–7].
В настоящей работе представлены результаты исследования сорбционной активности модифицированных форм каолинита и монтмориллонита по отношению к ионам железа (III).
Материалы и методы исследования
Исследуемые сорбенты измельчали, просеивали и для исследования отбирали сорбент с фракционным размером частиц 1–2 мм. Для получения химически модифицированных форм исследуемых сорбентов навески каолинита и монтмориллонита массой 1 г обрабатывали растворами HCl, NaOH и NaCl. Таким образом были получены: Н-форма, OH-форма и Na-форма сорбентов. Эксперимент проводили при температуре 25 °С.
Сорбцию ионов Fe (III) на модифицированных формах исследуемых сорбентов проводили в статических условиях из хлоридных растворов методом переменных концентраций. Методика проведения эксперимента описана в работе [4]. Начальное и равновесное содержание Fe (III) определяли комплексонометрическим титрованием по методике [8].
Природный каолинит – минерал слоистых силикатов, является одним из главных глинистых минералов, составляет основу каолина, входит в состав глин, мергелей и глинистых сланцев. В основе структуры каолинита лежат многочисленные слои, состоящие из тетраэдров SiO4. Такие тетраэдры имеют три общих атома кислорода и связаны они через свободные вершины атомом алюминия и гидроксогруппой (рис. 1). Слоистая структура каолинита придает глинам и каолинам свойство пластичности [9].
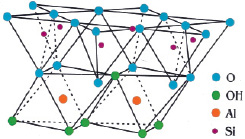
Рис. 1. Структура каолинита
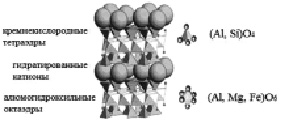
Рис. 2. Структура монтмориллонита
Монтмориллонит – является глинистым минералом из группы смектитов подкласса слоистых силикатов, являющимся основным компонентом бентонита. Химический состав минерала непостоянный и сильно зависит от различного содержания воды в нем. Существуют различные разновидности монтмориллонита: Mg-монтмориллонит, Cu-Fe-монтмориллонит, Ca-монтмориллонит, ферримонтмориллонит и другие [9]. Кристаллическая структура монтмориллонита состоит из симметрично сложенных пачек слоев, между которыми находятся молекулы воды и атомы металлов Ca, Na и другие (рис. 2). Между пачками слоев достаточно большие расстояния, поэтому при смачивании минерал сильно набухает [9].
Химический состав исследуемых сорбентов, полученный с помощью электронной микроскопии, представлен в работах [10, 11].
Результаты исследования и их обсуждение
Для достижения поставленной цели в работе на основе полученных экспериментальных данных рассчитывали величину адсорбции (Г) по уравнению
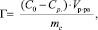 (1)
(1)
где С0 – концентрация катионов железа (III) в исходном растворе, ммоль/мл; Ср – равновесная концентрация катионов железа (III) в растворе после сорбции, ммоль/мл; V – объем модельного раствора, мл; mс – масса сорбента, г.
На основе рассчитанных величин удельной сорбции строили изотермы ионов железа (III) в статических условиях. Изотермы сорбции дают представление о сорбционной активности исследуемых сорбентов и о характере процесса сорбции катионов железа (III). На рис. 3 представлены изотермы для различных форм монтмориллонита, на рис. 4 – для каолинита.
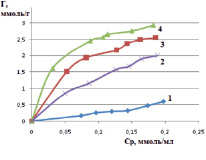
Рис. 3. Изотермы сорбции катионов железа (III) в статических условиях на различных формах монтмориллонита: 1 – природная, 2 – Н-форма, 3 – OH-форма, 4 – Na-форма
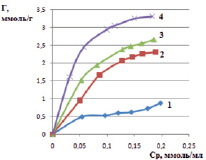
Рис. 4. Изотермы сорбции катионов железа (III) в статических условиях на различных формах каолинита: 1 – природная, 2 – Н-форма, 3 – OH-форма, 4 – Na-форма
По теории БЭТ (классификация Брунауэра, Эммета и Теллера) представленные на рис. 3 и 4 изотермы соответствуют виду изотерм I типа. Изотермы такого типа характеризуют сорбцию мономолекулярным слоем [12]. На изотермах присутствуют выпуклые участки, которые определяют наличие микропор в исследуемых сорбентах. Полученные экспериментальные данные показывают, что исследованные сорбенты в модифицированном виде (Na-форма и ОН-форма) обладают повышенной сорбционной способностью к извлекаемому иону железа (III). Сорбционная емкость для каолинита в ОН-форме составила 2,52 ммоль/г, в солевой форме – 3,39 ммоль/г; для монтмориллонита в ОН-форме составила 2,51 ммоль/г, в солевой форме – 2,95 ммоль/г.
Изотермы адсорбции обрабатывали с помощью уравнения Ленгмюра:
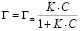 (2)
(2)
или в линейной форме [13]:
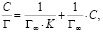 (3)
(3)
где Г – сорбционная емкость сорбента, моль/г; Г∞ – предельная сорбционная емкость монослоя, моль/г; K – константа сорбционного равновесия; С – равновесная концентрация ионов железа (III) в растворе, моль/л.
Изотермы в линейном виде для монтмориллонита (рис. 5, А) и для каолинита (рис. 5, Б) дают возможность определить постоянные величины Ленгмюровской изотермы (Г∞ и K). По тангенсу угла наклона построенной прямой находим Г∞ (tgα = 1/Г∞), а по отрезку, отсеченному на оси ординат и равному 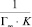 , находим константу сорбционного взаимодействия [14].
, находим константу сорбционного взаимодействия [14].
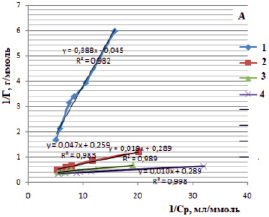
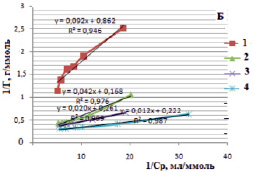
Рис. 5. Изотермы Ленгмюра в линейной форме для сорбции ионов железа (III) на монтмориллоните (А) и на каолините (Б) в различных формах: 1 – природная, 2 – Н-форма, 3 – ОН-форма, 4 – солевая форма
В таблице представлены рассчитанные значения постоянных величин уравнения Ленгмюра.
Постоянные величины уравнения Ленгмюра для сорбции ионов железа (III) из водных растворов на различных формах каолинита и монтмориллонита
|
Формы сорбентов |
каолинит |
монтмориллонит |
||||
|
Г∞ ммоль/г |
К, л/ммоль |
R2 |
Г∞ ммоль/г |
К, л/ммоль |
R2 |
|
|
природная |
10,87 |
0,86 |
0,946 |
5,27 |
0,43 |
0,982 |
|
Н-форма |
23,81 |
2,31 |
0,976 |
21,28 |
1,96 |
0,983 |
|
ОН-форма |
49,72 |
4,67 |
0,979 |
45,56 |
3,44 |
0,989 |
|
Na-форма |
83,33 |
6,11 |
0,987 |
67,04 |
5,23 |
0,998 |
Из полученных данных таблицы видно, что солевая форма монтмориллонита и каолинита проявляет наибольшее сродство к ионам железа (III).
Выводы
Анализируя полученные результаты, можно сделать вывод, что солевая и щелочная форма исследованных сорбентов имеет большее число активных центров, а поэтому обладает большим сродством по отношению к ионам железа. На основе рассчитанных констант сорбционного взаимодействия сорбента и сорбтива модифицированные формы монтмориллонита и каолинита образуют следующий ряд: Na-форма > ОН-форма > Н-форма > природный сорбент.



