Соединения европия с тетраэдрическими анионами, обладая рядом весьма ценных свойств, в последние годы все чаще привлекают внимание исследователей [1–3]. Исследование люминесценции двухвалентного европия имеет как фундаментальное, так и практическое значение [4–6]. Соединения Eu2+и системы с его участием можно использовать в создании сцинтилляторов обнаружения гамма-лучей [7] и в качестве излучающего центра в лазерных материалах [8]. Многообещающими являются заявления о возможности создания эффективных трехцветных люминофоров, содержащих соединения двухвалентного европия [9], а также систем контроля валентного состояния мультимодальных, чувствительных к окислению контрастных веществ для магнитно-резонансной тамографии [10, 11]. По своим свойствам ион Eu2+ подобен аналогичным ионам щелочноземельных металлов [3–5] и в особенности стронцию (r(Eu2+) = 0,112 нм, r(Sr2+) = 0,127 нм).
В то же время большинство исследований посвящено системам, в которых ион Eu2+выступает в качестве легирующего, с достаточно низкой концентрацией. Неочевидность кристаллографических позиций излучающего иона затрудняет определение взаимосвязи между спектральными свойствами и локальным окружением в структуре. В результате чего актуальна разработка экспериментальной и теоретической базы для создания самоактивированных люминофоров, в которых координация излучающего иона может быть точно описана при помощи методов современного рентгеноструктурного анализа [12–14].
Цель исследования: разработка методов получения сульфата европия (II), исследования его кристаллической структуры и ее взаимосвязи с люминесцентно-спектральными свойствами, а также изучение термической устойчивости соединения и определение его термохимических характеристик.
Материалы и методы исследования
Поликристаллический препарат сульфата европия (II) получали восстановлением раствора хлорида европия (III) в редукторе Джонса на цинковой амальгаме в 8H серной кислоте в инертной атмосфере.
Сульфид европия (II) получали методом высокотемпературной обработки оксида европия Eu2O3в атмосфере сероуглерода.
Для увеличения скорости взаимодействия сульфида европия (II) с водным раствором серной кислоты применяли ультразвуковую ванну с частотой ульразвука 42 кГц.
Растровая электронная микроскопия проведена на электронном микроскопе JEOL JSM 6510 LV.
Рентгеноструктурный анализ (РСА) проведен на дифрактометре BRUKER D2 PHASER с линейным детектором LYNXEYE (CuKα-излучение, Ni-фильтр). Уточнение структуры производилось методом Ритвельда в программе DIFFRAC.TOPAS. Для визуализации кристаллической структуры и ее основных элементов использован пакет программ Diamond 3.
Инфракрасная спектроскопия проведена на ИК-Фурье-спектрометре ФСМ 1201. Образец для исследования готовили в виде таблетки с прокаленным бромидом калия.
Спектры возбуждения люминесценции и спектры люминесценции при комнатной температуре регистрировали на спектрометре Shimadzu RF-5301. Источником света в приборе является ксеноновая лампа мощностью 150 Вт.
Результаты исследования и их обсуждение
По данным растровой электронной микроскопии (рис. 1) образец сульфата европия (II), полученный восстановлением на редукторе Джонса, в основном состоит из ограненных частиц с размерами 10–50 мкм. В строении частиц прослеживается ромбоэдрический мотив.

Рис. 1. Электронно-микроскопический снимок порошка сульфата европия (II)
По данным рентгеноструктурного анализа (рис. 2) сульфат европия (II) EuSO4 кристаллизуется в ромбической сингонии, основные кристаллографические характеристики приведены в таблице.
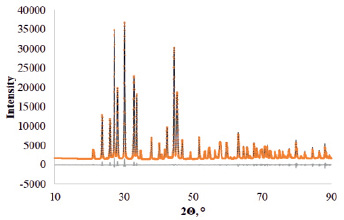
Рис. 2. Дифрактограмма EuSO4 , после уточнения методом Ритвельда
Кристаллографические параметры сульфата европия (II)
|
Формула |
EuSO4 |
|
Сингония |
ромбическая |
|
Пространственная группа |
Pnma |
|
Z |
4 |
|
a, Å |
8,387 |
|
b, Å |
5,344 |
|
c, Å |
6,879 |
|
V, Å3 |
308,318 |
|
R(F) |
4,11 |
|
Rwp |
3,96 |
|
Rp |
2,16 |
В структуре (рис. 3) все атомы европия восьмикоординированы и занимают идентичные кристаллографические позиции. Шесть сульфатных групп связывают ион европия монодентатно, а одна хелатно, в результате чего формируется координационный многогранник в форме двухшапочной тригональной призмы. Хелатные связи существенно длиннее монодентатных, в результате чего координационное число европия следует принимать как 6 + 2.
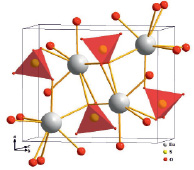
Рис. 3. Перспективная проекция кристаллической структуры EuSO4
Двухшапочные тригональные призмы [EuO8], попарно соединяясь ребрами, формируют зигзагообразные цепи в направлении b (рис. 4, а). В направлении с восьмивершинники [EuO8] связываются друг с другом через вершины двух сульфатных тетраэдров, формируя прямую цепь (рис. 4, б). Подобный механизм связывания координационных многогранников приводит к формированию трехмерной каркасной структуры.

а)
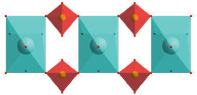
б)
Рис. 4. Строение цепей координационных многогранников [EuO8]n (а) и {[EuO8](SO4)2[EuO8]}n (б)
В инфракрасном спектре (рис. 5, а) соединения наблюдаются только характеристические полосы валентных колебаний сульфатных групп. Разрешенные полосы в области 1000–1400 см-1 относятся к несимметричным валентным колебаниям группы SO4. Узкая полоса в области 980 см-1 отнесена к полносимметричному валентному колебанию сульфатной группы. Разрешенные полосы в области 500–700 см-1 вызваны несимметричными деформационными колебаниями сульфатной группы.
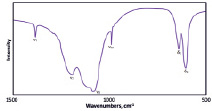
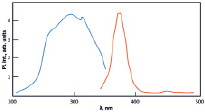
а) б)
Рис. 5. ИК-спектр (а) и спектр люминесценции (б) сульфата европия (II)


а) б)
Рис. 6. Электронно-микроскопические изображения частиц EuSO4, полученных по реакции взаимодействия моносульфида европия с серной кислотой: а) при перемешивании; б) при воздействии ультразвуковых колебаний
На рис. 5, б, приведен спектр возбуждения (голубая линия) и спектр излучения фотолюминесценции (красная линия). Спектр люминесценции показывает эффективное излучение в области 317 нм, при длине волны возбуждения 291 нм, что соответствует межконфигурационным d→f излучательным переходам. Излучение возникает при переходе электрона с нижнего уровня 4f65d1в основное состояние 4f75d0.
Разработан метод получения мелкодисперсных порошков сульфата европия (II) основанный на взаимодействии моносульфида европия EuS с водными растворами серной кислоты.
Установлено, что взаимодействие моносульфида европия с 10 %-ным раствором H2SO4 протекает по уравнению
EuS + H2SO4 → EuSO4 + H2S.
Реакция при комнатной температуре протекает очень медленно. Для полного растворения навески EuS массой 0,50 г требуется ~30 мин. По данным РФА, поликристаллический продукт реакции, окрашенный в белый цвет, представляет собой сульфат европия (II) EuSO4. Рефлексы на дифрактограмме значительно уширены и имеют маленькую интенсивность. По данным электронной микроскопии, порошок EuSO4, полученный при взаимодействии моносульфида европия с раствором серной кислоты, преимущественно сформирован частицами с размером от 100 нм до 1 мкм (рис. 6, а). Объединяясь, частицы образуют агломераты размером до 5 мкм.
На скорость растворения сульфидов в серной кислоте преимущественно влияют два фактора:
– образование в процессе реакции затрудняющего слоя нерастворимого соединения на поверхности частиц;
– структурное затруднение, связанное с гораздо большей симметричностью и плотностью шаровой упаковки в структуре моносульфида европия, по сравнению, например, с полуторными сульфидами редкоземельных элементов, которые с легкостью взаимодействуют с водными растворами кислот, в том числе и серной, с широком диапазоне концентрации кислоты и несмотря на образование нерастворимых продуктов реакции.
Для снижения влияния данных факторов принято решение проводить реакцию взаимодействия порошка сульфида с 10 %-ным раствором H2SO4 при воздействии ультразвуковых колебаний. Установлено, что в ультразвуке взаимодействие протекает гораздо быстрее. Для полного растворения навески потребовалось примерно 2 мин.
По данным рентгенофазового анализа поликристаллический препарат, полученный в результате взаимодействия, как и в предыдущем случае, является соединением EuSO4, однако, судя по виду дифрактограммы, порошок состоит из еще более мелких частиц: рефлексы на дифрактограмме просматриваются еще слабее.По данным электронной микроскопии, порошок сульфата европия (II) EuSO4 сформирован преимущественно сферическими частицами с размером от 0.5 до 1 мкм. Так же в образце присутствуют более мелкие частицы и их агломераты (рис. 6, б)
Заключение
Таким образом, установлено, что сульфат европия (II) кристаллизуется в ромбической сингонии, пр.гр. Pnma. Каркасная структура образована пересечением цепей [EuO8]n и {[EuO8](SO4)2[EuO8]}n. Оптические свойства соединения находятся в полной согласованности со структурной моделью.
Разработан метод синтеза мелкодисперсных порошков сульфата европия (II) EuSO4, заключающийся во взаимодействии моносульфида европия с водными растворами серной кислоты. Установлено, что проведение реакции в среде ультразвуковых колебаний приводит к существенному увеличению скорости процесса.



