Современными методами нанотехнологий установлена высокая роль геля силиката кальция – C-S-H в механизме твердения бетона [1–2]. Гель C-S-H имеет слоистую структуру на малом масштабе 1–5 нм, структуру доменов, состоящих из слоев, и на большем масштабе 5–100 нм – трехмерные структуры с формой дисков размерами 60×30×5 нм3, состоящих из доменов. В ходе гидратации частицы-домены агрегируют, образуя гель. Гель C-S-H может иметь низкую, высокую и ультравысокую плотность и, соответственно, различную прочность. Пропорция этих трех форм геля может меняться в зависимости от цемента и характеристик замеса. Гель C-S-H не имеет фиксированной стехиометрии, химический состав геля меняется от точки к точке внутри объема замеса, поэтому гель C-S-H характеризуют отношением Ca/Si. По данным сканирующей электронной микроскопии и трансмиссионной электронной микроскопии отношение Ca/Si варьирует внутри C-S-H геля в пределах 0,6–2,0.
Наночастицы, обладающие большой удельной поверхностью (до 1000 м2/г), отличаются химической активностью. Они могут действовать как центры, ускоряющие реакции гидратации, а также как нанонаполнители, повышая плотность бетона и уменьшая пористость.
Ультрадисперсные материалы (УДМ) на основе аморфных SiO2ам типа микрокремнезёма (CSF – condensedsilicafume) [3–5] обычно в присутствии суперпластификаторов с ВРС более 20–30 % существенно изменяют морфологию и структуру цементных композиций, обеспечивая повышенные показатели плотности, прочности и коррозионной стойкости. Основными структурообразующими характеристиками таких материалов являются размер частиц и их химическое сродство (способность к связыванию СаО) к щелочной (СаО, R2О) жидкой фазе цемента (Ц).
Согласно существующим представлениям, высокодисперсные частицы CSF (d = 0,15–0,3 мкм) заполняют межзерновое пространство между «грубыми» частицами цемента (d = 30–100 мкм), уплотняя структуру и обеспечивая стеснённые условия взаимодействия CSF с Ca(OH)2 жидкой фазы Ц.
Аморфная структура CSF предопределяет его быстрое взаимодействие с Ca(OH)2 с образованием гидросиликатов кальция (ГСК) коллоидно-гелевой дисперсности.
В результате этих процессов образуется субмикрогелевая гидросиликатная взвесь, вязкость которой обеспечивает бесседиментационное размещение реагирующих частиц CSF и цемента в порах Цм и на границе с заполнителем.
Частицы CSF имеют химическое сродство с поровой жидкостью Ц (Ca(OH)2, КОН, NaO), обладают высокой способностью к хемосорбции СаО и выполняют роль силикатных центров зародышеобразования возникающих на их поверхности гидросиликатов.
Для CSF в цементных материалах наиболее цитируемой является реакция SiO2 + CаО+Н2О→СаО?SiO2?Н2О без указания роли R2О. Есть сведения, что в присутствии CSF крупные кристаллы Ca(OH)2 не возникают, что способствует образованию более прочной мелкозернистой структуры. На наш взгляд, это вызывает сомнение, так как конкурентность гидролизующихся Ca(OH)2 и СаО?SiO2?Н2О из 3СаО?SiO2 должна сохраняться.
Конструктивная роль CSF по прочности бетона для дозировки CSF 10–20 % подтверждается во многих работах [3–5], но её проявление (Rsi > Rб/д) начинается не ранее 7–30 сут.
Прочность на разрыв образующихся гидросиликатов существенно превышает прочность Цк и достигает 700–800 МПа для CSН (I) и 1000–1300 МПа для CSН (II) [6–9].
В литературе есть данные о существенном повышении прочности бетонов за счет ввода добавок нанокремнезема [10–13]. Возникает вопрос о механизме повышения прочности, одним из составляющих которого является пуццолановая реакция Ca(OH)2c наночастицами SiO2, и структуре образующихся гидросиликатов кальция.
Получение золей и нанопорошков SiO2
Золи и порошки нанокремнезема получали на основе гидротермального раствора.
Кроме кремнезема в исходном растворе находятся другие компоненты, концентрации которых приведены в табл. 1.
Таблица 1
Концентрация основных компонентов исходного гидротермального раствора, pH = 9,2
|
Компонент |
Nа+ |
К+ |
Li+ |
Са2+ |
Мg2+ |
Fe2+, 3+ |
Al3+ |
Сl - |
SO42 |
HCO3- |
CO32- |
H3BO3 |
SiO2 |
|
Концентрация, мг/дм3 |
282 |
48,1 |
1,5 |
2,8 |
4,7 |
<0,1 |
<0,1 |
251,8 |
220,9 |
45,2 |
61,8 |
91,8 |
780 |
Концентрированные водные золи кремнезема получали из жидкой фазы гидротермальных растворов трехступенчатым ультрафильтрационным мембранным концентрированием: на 1-й ступени содержание SiO2 в золе повышали от 0,05 до 0,3–0,4 мас. %,на 2-й ступени до10 мас. %, на 3-й до 20–30 мас. % и выше.
Для получения нанопорошков SiO2 золи сублимировали на установке УВС-2Л, включающей блоки диспергирования, получения криогранул в сосудах Дьюара, вакуумной камеры и десублиматора. Перед сублимацией в вакуумной камере золи кремнезема диспергировали с помощью форсунки, капли отверждали в жидком азоте при температуре 77 К и получали криогранулы. После диспергирования размер капель золя составлял 30–100 мкм. Вакуумная сублимация проходила при давлениях 0,02–0,05 мм рт. ст. без фрагментов капельной влаги и слипания частиц. Для ускорения сублимации использовался нагрев: диапазон температур поверхностей нагрева в разных частях вакуумной камеры по мере нагрева в ходе сублимации был от –80 до +25 °C.
Хемосорбция Ca(OH)2 на аморфных кремнеземсодержащих материалах. Методика проведения эксперимента
Оксид кальция был получен термическим разложением карбоната кальция (CaCO3, ч.д.а.) при 1000 °C в муфельной печи МП-8. Раствор гидроксида кальция получали растворением оксида кальция в дистиллированной воде с последующим центрифугированием на центрифуге Sigma 2-16P (4500 об/мин). Раствор гидроксида кальция хранился в пластиковой бутылке, заполненной аргоном. Концентрация CaO 1,05 г/дм3. Газ аргон (99,993 %, сорт высший ГОСТ10157-79).
Для титрометрического определения кальция использовались: раствор гидроксида натрия (2 N), раствор трилона Б (0,05 N), индикатор мурексид (хч). Для определения концентрации Ca2+ отбирали пипеткой 1 мл анализируемого раствора в коническую колбу (100 мл) для титрования, прибавляли 10 мл воды, 2 мл раствора гидроксида натрия, 20–30 мг мурексида и титровали раствором трилона Б. Окраска в конечной точке титрования превращалась из розовой в фиолетовую. Молярную концентрацию (моль/л) кальция рассчитывали по формуле:
CCa = V1?C1/(2?V2), (*)
где V1 – объем раствора трилона Б, C1 – концентрация раствора трилона Б, V2 – объем анализируемого раствора.
Изучали три различных кремнеземсодержащих материала: Геосил, CSF, брянский трепел.
В коническую колбу (250 мл, NS 29/32) с магнитным мешальником Heidolph MR 3001 помещали исследуемый материал, наливали раствор гидроксида кальция, заполняли аргоном и закрывали стеклянной пробкой (NS 29/32). Эксперимент проводили при перемешивании на магнитной мешалке. Пробу отбирали с временными промежутками 15 мин, 5 ч, 24 ч, 3 д, 5 д и т.д., до прекращения изменения концентрации гидроксида кальция. По окончании эксперимента осадок центрифугировали (4500 об/мин), промывая охлажденной (8–12 °C) дистиллированной водой до нейтрального pH. Затем осадок центрифугировали (4500 об/мин), промывая 3 раза ацетоном ч.д.а. для удаления воды. В конце осадок сушили в вакуумном шкафу при 50 °C, 10 мм рт. ст. Выделенные образцы были запаяны в ампулы в атмосфере аргона.
Морфологию образцов изучали на сканирующем электронном микроскопе (ЭСМ) Hitachi S5500 (Япония). Локальный элементный состав образцов определяли методом энерго-дисперсионной спектроскопии (ЭДС) на спектрометре Thermo Scientific (США), установленном в виде приставки на микроскопе Hitachi S5500. Химический состав образцов определялся на микроанализаторе JXA8100, Джеол, Япония, оснащенном тремя волновыми спектрометрами и ЭДС приставкой INCAx-sight, Оксфорд, Великобритания. Рабочее напряжение 20kV, ток 1*10-8 А. Определяемые элементы от В до U.
Результаты экспериментов
Получены данные по сорбции Ca(OH)2 аморфными кремнеземами в атмосфере аргона (рис. 1). Связывание Ca(OH)2 быстрее проходило на образце Геосил, имеющем наибольшую удельную поверхность. Особенно сильно разность в связывании Ca(OH)2 между тремя образцами была выражена в первые часы реакции. На момент времени 200 ч связывание по CaO для Геосила составило порядко 680 мг CaO/1 г SiO2, для CSF – 325 мг CaO/1 г SiO2, для трепела – 200 мг CaO/1 г SiO2. С течением времени происходило выполаживание кривых на рис. 1.
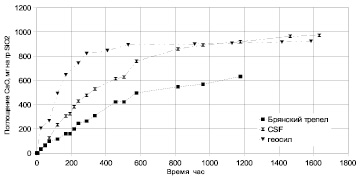
Рис. 1. Данные по кинетике связывания CaO образцами Геосил, CSF и трепел
В табл. 2 показано конечное изменение массы трех различных кремнеземов после прекращения связывания CaO. Согласно данным табл. 2, масса образцов Геосил и CSF после насыщения увеличилась более чем в два раза.
Таблица 2
Изменение массы препаратов после насыщения в известковой воде Ca(OH)2
|
Сорбент |
Удельная площадь поверхности, м2/г |
Исходная масса, г |
Масса после завершения сорбции, г |
Приращение массы, раз |
|
Геосил |
418 |
1,059 |
2,39 |
2,25 |
|
Микрокремнезем CSF |
20 |
0,53 |
1,17 |
2,21 |
|
Трепел (брянский) |
0,6 |
0,51 |
0,867 |
1,7 |
При увеличении массы после взаимодействия с Ca(OH)2 в составе образцов установлено присутствие вместе с Si значительных количеств Ca (образец Геосил, табл. 3).
Таблица 3
Химический состав (оксиды) образца Геосил после насыщения в ходе взаимодействия с Ca(OH)2 (мас. %)
|
Spectrum |
In stats. |
Al |
Si |
Ca |
Total |
|
Spectrum 1 |
Yes |
29,83 |
26,15 |
55,98 |
|
|
Spectrum 2 |
Yes |
27,08 |
22,29 |
49,38 |
|
|
Spectrum 3 |
Yes |
26,77 |
22,71 |
49,47 |
|
|
Spectrum 4 |
Yes |
26,84 |
21,42 |
48,26 |
|
|
Spectrum 5 |
Yes |
0,33 |
30,82 |
26,74 |
57,89 |
|
Max. |
0,33 |
30,82 |
26,74 |
||
|
Min. |
0 |
26,77 |
21,42 |
Данные по исходному образцу Геосил до взаимодействия с Ca(OH)2
С помощью электронной сканирующей микроскопии получены изображения фрагментов исходного порошка аморфного нанокремнезема до взаимодействия с известью:
– изображение остроугольной частицы (максимальный размер 30 мкм; энергодисперсионным анализом других элементов кроме Si и O не обнаружено);

Рис. 2. СЭМ изображение мелкозернистой, пухоподобной области (размер образования – 1000×2000 нм), размер зерен менее 20 нм
– изображение мелкозернистой, пухоподобной области (размер образования – 1000×2000 нм, размер частиц – за пределами разрешения; следует отметить, что подобные образования полностью исчезают в результате взаимодействия с Са(ОН)2) (рис. 2);
– изображение осколков жеоды, пластины (размеры частиц до 50 мкм, на осколке в центре проведен энергодисперсионный анализ);
– изображение пластин, образующих друзоподобный объект, на поверхности которых более мелкие частицы и пухоподобные области и образования;
– жеодообразное образование, состоящее из разнообразных, в том числе и пластинчатых объектов (максимальный размер образования – 60 мкм; форма образования сходна с формой гидросиликатов кальция, формирующихся в результате реакции с Са(ОН)2 по механизму метосоматоза с сохранением формы исходного вещества (псевдоморфоз));
– изображение овальных частиц, размером около 1 мкм, припудренных более мелкими частицами, образующими пухоподобные области;
– изображение овальной частицы при большем увеличении, рыхлое образование, сложенное более мелкими частицами, такими же, которые образуют пухоподобные области;
– изображение той же овальной частицы, но при большем увеличении, при этом хорошо видна рыхлость образования, сложенного более мелкими, разноразмерными частицами (при реакции с Са(ОН)2 такие образования растворяются и вещество переотлагается).
По данным энергодисперсионной спектроскопии в образцах Геосила до взаимодействия с Ca(OH)2 доля Ca по отношению к Si была мала (рис. 3, 4).
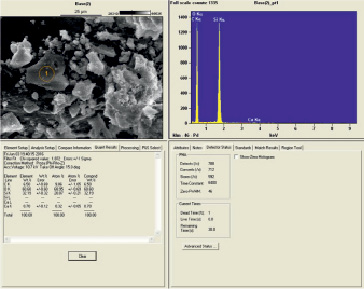
Рис. 3. СЭМ изображение остроугольной частицы и данные энерго-дисперсионного анализа области, выделенной на СЭМ изображении окружностью (максимальный размер частиц 30 мкм; энергодисперсионным анализом других элементов кроме Si и O не обнаружено)
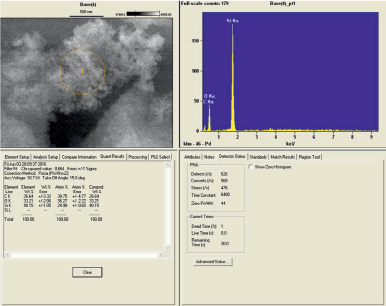
Рис. 4. СЭМ-изображение пухоподобной области и данные энерго-дисперсионного анализа области, выделенной на СЭМ-изображении окружностью (энергодисперсионным анализом других элементов кроме Si и O не обнаружено)
Данные по образцу, полученному после взаимодействия Геосила с Ca(OH)2
С помощью сканирующей электронной микроскопии получены изображения фрагментов материала, образовавшегося после взаимодействия исходного порошка аморфного нанокремнезема с известью (рис. 5):
– общий вид многочисленных образований, повторяющих форму материнского порошка SiO2, включая редкие прямоугольные формы, встречающиеся в исходном материале;
– общий вид, но при большем увеличении;
– изображение частицы гидросиликата кальция (соотношение CaO/SiO2 – 8/1, форма частицы уплощенная, максимальный размер 25 мк);
– изображение частицы гидросиликата кальция (соотношение CaO/SiO2 – 1/1, форма частицы уплощенная, структура слоистая, максимальный размер 20 мк);
– изображение частицы гидросиликата кальция (соотношение CaO/SiO2 – 1/1, форма частицы жеодообразная, максимальный размер 50 мк);
– изображение частицы гидросиликата кальция, жеодообразной, состоящей из слоев с признаками осаждения и растворения, присутствуют более мелкие частицы, что подтверждает реакцию SiO2c известковым раствором, максимальный размер 20 мк;
– изображение частицы гидросиликата, аналогичной предыдущей, при этом ярко выражена слоистость, максимальный размер 40 мк;
– изображение частицы гидросиликата, аналогичное предыдущей, ярко выражена слоистость, максимальный размер 30 мк, на поверхности видны плоские, слоистые частицы размером 1–6 мк;
– листочки «фольги» и друзообразные образования гидросиликата кальция (толщина «фольги» 5–10 нм, максимальный размер образования до 500 нм; «фольга» и друзы отсутствуют в исходном порошке SiO2 и являются продуктами реакции с известью);
– та же область, снятая при меньшем увеличении, при этом видно, что друзы не являются единичными образованиями и могут отличаться по размерам и строению;
– общий вид площади 100х70 мк, видны частицы гидросиликата кальция различного размера и формы, отсутствует «пыль» и ажурные образования, в большом количестве присутствующие в исходном SiO2; можно предположить, что мелкие частицы и ажурные образования растворяются в результате реакции и в дальнейшем осаждаются на поверхности более крупных частиц, образуя слоистую, или псевдослоистую структуру; размер частиц от 30 мк и меньше.

Рис. 5. Общий вид многочисленных образований, повторяющих форму материнского порошка SiO2, включая редкие прямоугольные формы, встречающиеся в исходном материале
Энергодисперсионной спектроскопией установлено, что доля Ca в образце Геосила после взаимодействия с Ca(OH)2 сопоставима с долей Si (7,47–5,57 мол. %, рис. 6).
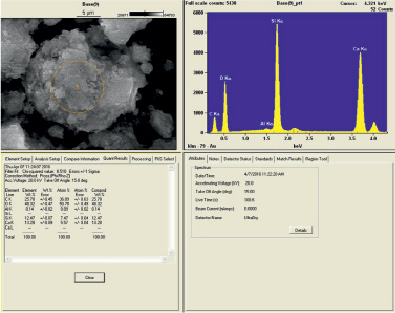
Рис. 6. Изображение слоистого объекта, возникшее после взаимодействия Геосила с Ca(OH)2 и данные энерго-дисперсионного анализа области, выделенной на ЭСМ-изображении окружностью (вместе с Si присутствует значительное количество Ca)
Определение водоотделения цемента в цилиндре
Эксперименты по определению седиментации осадка показали, что ввод относительно небольшого количества золя SiO2 (1 мас. % по сухому веществу относительно цемента) приводит к быстрому (2 ч) появлению большого количества ультрадисперсных частиц гидросиликатов кальция, которые тормозят оседание границы цемент-вода и изменяют объём осевшей части более чем в 2 раза. При добавлении вместе с золем SiO2 суперпластификатора происходит расслоение: слой над цементом делится на два – верхний – полупрозрачный и нижний – мутный (рис. 7–9).

|
Рис. 7. Цемент ПЦ500-Д0: Вода = 1:1. Оседание 145 мм (2 ч): осадок 105 мм, жидкость 145 мм |
Рис. 8. Цемент ПЦ500-Д0: Ж = 1:1 (Ж = Вода + (1 % SiO2)). Оседание 12 мм (2 ч): осадок 238 мм, жидкость 12 мм |
Рис. 9. Цемент ПЦ500-Д0: Ж = 1:1, (Ж = Вода + (1 % SiO2 ) + Sika Visco Crete) Оседание (2 ч): осадок 194 мм, жидкость 1-ый слой 16 мм, жидкость 2-ой слой 40 мм |
Нормальная густота и сроки схватывания цементного теста ПЦ500-Д0 без добавок и добавками золя Геосил и суперпластификатора SikaViscoCreete 5.600, определенные по методике ГОСТ 310.3-76, удовлетворяли требованиям ГОСТ 10178. Методика: ГОСТ 26798.1-96 Цементы тампонажные. Методы испытаний. п. 8. Определение водоотделения (табл. 4).
Таблица 4
Водоотделение цементного теста при добавлении золя и суперпластификатора
|
Н2О |
Н2О + SiO21 % |
Н2О + SiO2 1 %, Sika5.600 |
|
|
1 |
2 |
3 |
4 |
|
Высота смеси в цилиндре, мм |
250 |
250 |
250 |
|
Осадок, мм |
105 |
238 |
194 |
|
Верхний слой (прозрачный), мм |
145 |
12 |
56 |
|
Верхний полупрозрачный, мм |
– |
– |
16 |
|
Верхний мутный, мм |
40 |
Выводы
1. Аморфный порошок гидротермального нанокремнезема Геосил в известковой и цементной среде обладает высокой хемосорбционной активностью по поглощению Ca(OH)2, превышающей хемосорбционную активность других аморфных кремнеземсодержащих материалов (микрокремнезем CSF, брянский трепел) с меньшей удельной поверхностью. Установленная в эксперименте хемосорбционная активность выше у материалов с большей удельной поверхностью: возрастает в ряду брянский трепел – CSF – Геосил.
2. Аморфный порошок гидротермального нанокремнезема Геосил в известковой среде обладает высокой хемосорбционной активностью по поглощению Ca(OH)2. Реакция сопровождается очень быстрым возникновением нанодисперсных седиментационно устойчивых частиц гидросиликатного состава xCaO•ySiO2•zH2O – как продукт реакции SiO2+Ca(OH)2 → CSH. Энергодисперсионный анализ показал присутствие значительного количества элемента Ca вместе с Si в продуктах реакции Геосила с Ca(OH)2. Прямые оценочные измерения массы SiO2ам до и после прохождения пуццолановой реакции показали более чем двухкратное ее приращение, что согласуется с уравнением вышеуказанной реакции.
3. Ввод золя SiO2 в смесь цемент – вода приводит к быстрому (2 ч) появлению большого дополнительного количества тонкодисперсных седиментационно-устойчивых частиц гидросиликата кальция, что замедляет оседание границы цемент – вода.



