Основным, широко используемым в промышленности способом разложения молибденитовых концентратов, независимо от типа выпускаемого продукта, является окислительный обжиг, который реализуется в печах различной конструкции при температурах 550–600 °С. Для многоподовых печей характерны относительно низкая производительность по концентрату 60–70 кг/м2 в сутки, пылеунос до 18 % (улавливается и возвращается в печь), малое извлечение рения (≤ 60 %), содержание серы в огарке ≤ 0,25 %. А для печей кипящего слоя – высокая производительность (1200–1300 кг/м2 в сутки), извлечение рения до 85 %, однако пылевынос составляет порядка 40 % (уловленная пыль обжигается в других печах или выщелачивается), содержание серы в огарке 0,6–0,8 % [1].
Слабыми сторонами обжиговых процессов является выделение сернистого газа, затраты по утилизации которого сопоставимы с затратами на обжиг. Кроме того, происходит улетучивание рения в виде оксида (Re2O7) и, соответственно, его низкое сквозное извлечение.
Кроме обжига существуют пирометаллургические и гидрометаллургические методы обработки молибденовых концентратов: спекание с кальцинированной содой, с сульфатом, сульфидом и хлоридом натрия, с кальцийсодержащими добавками с последующим выщелачиванием [2–4]; с кремнием с получением дисилицида молибдена методом самораспространяющегося высокотемпературного синтеза [5]; обжиг в плазматроне со свободно плавающим плазмоидом с получением чистого триоксида молибдена [6]; выщелачивание гипохлоритами щелочных металлов, под давлением кислорода воздуха, биовыщелачивание [7–9]; использование твердофазных окислителей (натриевая, калиевая селитра, хлорноватокислый калий) с последующим выщелачиванием водными растворами азотной кислоты [10]. Степень извлечения молибдена этими методами высока, но все они имеют ряд недостатков, высокое потребление электроэнергии, химически чистых реагентов и сложного оборудования.
Цель настоящего исследования – повышение эффективности окислительного обжига молибденовых концентратов за счет использования в качестве сырьевой добавки одного из магнийсодержащих соединений природного происхождения – доломита (CaMg(CO3)2) или магнезита (MgCO3), приводящих к удешевлению процесса обжига и эффективному взаимодействию продуктов разложения с образованием растворимых соединений.
Материалы и методы исследования
В технологических исследованиях использовали: молибденовый концентрат, состава, %: 47,2 Mo; 35,18 S, полученный селективной флотацией медно-молибденовых руд месторождения Эрдэнэтийн-Овоо (Монголия), доломит Тарабукинского месторождения (Республика Бурятия) и магнезит Савинского месторождения (Иркутская область).
Рентгенофазовый анализ (РФА) исходных веществ и продуктов реакций окислительного обжига молибденитового концентрата определяли методом рентгеновской дифракции на дифрактометре D8 ADVANCE (Bruker AXS, Германия).
Термический анализ магнезита и доломита проводился методами термогравиметрии (ДГ) и дифференциальной сканирующей калориметрии (ДСК) с применением синхронного термического анализатора STA 449 F1 Jupiter (Netzsch, Германия). Данный термический анализ позволяет выявить и исследовать фазовые превращения, протекающие в образцах при нагревании или охлаждении по термическим эффектам и потерям массы [11].
Для прогнозирования и исследования равновесного распределения компонентов при обжиге молибденита с доломитом или магнезитом был использован программный комплекс «TERRA», позволяющий определить вероятные фазовые состояния в изучаемых системах при различных температурах. Термодинамические функции ряда веществ, отсутствующих в базах данных TERRA и ASTRA, взяты из справочника [12].
Разложение исходных материалов и продуктов реакции окислительного обжига молибденового концентрата проводили при использовании системы микроволнового разложения проб Mars 6 (CEM, США). Химический анализ исходных материалов и продуктов реакции окислительного обжига молибденового концентрата определяли методом атомно-абсорбционной спектрометрии на спектрометре SOLAAR M6 (Thermo Electron, США) и фотоколориметрическим методом на спектрофотометре ПЭ–5300B (Экохим, Россия). Экспериментальные исследования процесса обжига молибденового концентрата с магнезитом и доломитом проводили в лабораторной муфельной печи СНОЛ 16251/9-И4.
Результаты исследования и их обсуждение
Доломит представляет собой минерал класса карбонатов, двойную углекислую соль кальция и магния CaMg(CO3)2 [13]. По данным термограммы процесс разложения доломита является двухстадийным. Первый эндотермический максимум в интервале температур 525–750 °C соответствует разложению доломита с образованием оксида магния, а второй – при 750–825 °С – образованию оксида кальция (рис. 1, а). В соответствии с рис. 1, б температурный диапазон разложения магнезита лежит в интервале температур 540–640 °С. Излом на кривой соответствует разложению карбоната магния, сопровождающемуся поглощением тепла и образованием оксида.
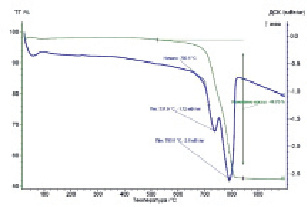
а)
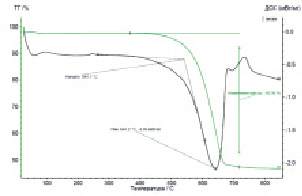
б)
Рис. 1. Термограмма разложения: а) доломит, б) магнезит
Возможность образования молибдатов при нагревании ряда оксидов и карбонатов с трехокисью молибдена была установлена Тамманом и др. по термограммам нагревания их смесей. Оксиды и карбонаты магния и кальция активно реагируют с трехокисью молибдена, образуя молибдаты кальция и магния. Известно, что в интервале температур 400–600 °С молибденит взаимодействует с кислородом воздуха с образованием MoO3 и выделением сернистого газа SO2. Взаимодействие МоО3 с CaO и CaCO3 с образованием CaMoO4 наблюдается при температурах 300–400 °С и активно протекает при температурах выше 500 °С. Оксид и карбонат магния реагируют с оксидом молибдена при температурах 500–700 °С с образованием молибдата магния [12]. Таким образом, доломит и магнезит можно использовать в качестве добавок при проведении окислительного обжига молибденового концентрата.
Термодинамическое моделирование
Основная задача моделирования термодинамического равновесия заключается в определении фазового и химического составов, а также значений термодинамических параметров исследуемой системы. Термодинамическое равновесие – предельное состояние, к которому стремится термодинамическая система, изолированная от внешних воздействий, т.е. в каждой точке системы устанавливается термическое, механическое и химическое равновесие (происходит выравнивание температуры и давления, и все возможные химические реакции протекают до конца) [14].
Расчеты полного равновесного состава для систем MoS2-CaMg(CO3)2-O2 и MoS2-MgCO3-O2 были выполнены до температуры 927 °С и при давлении 0,1 МПа. С помощью полученных данных можно прогнозировать распределение элементов по фазам. На рис. 2 представлена диаграмма равновесного распределения компонентов системы молибденит – доломит. Из результатов выполненных расчетов видно, что содержание углекислого газа и молибдата магния начинает увеличиваться с ростом температуры и достигает некоторого предельного значения при 427 °С, что связано с диссоциацией карбоната магния и взаимодействием продуктов распада с шестивалентным оксидом молибдена. При этом в системе наблюдаются уже образовавшиеся сульфат и молибдат кальция, возможно из-за того, что взаимодействие CaCO3 с MoO3 начинается при температурах значительно ниже температуры диссоциации карбоната кальция (800–900 °С) [1]. Свыше 827 °С в системе начинает появляться сернистый ангидрид SO2 и оксид магния MgO, вероятно, вследствие диссоциации сульфата магния.
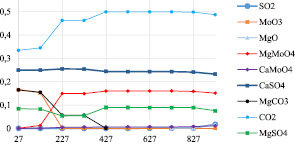
Рис. 2. Изменение фазового состава в системе MoS2-CaMg(CO3)2-O2
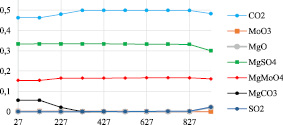
Рис. 3. Изменение фазового состава в системе MoS2-MgCO3-O2
На рис. 3 представлена диаграмма равновесного распределения компонентов системы MoS2-MgCO3-O2. Диссоциация карбоната магния с выделением углекислого газа протекает до температуры 527 °С. При этом в системе увеличивается количество молибдата магния, а содержание оксида молибдена VI снижается. Так же, как и в случае обжига с доломитом, свыше 827 °С в системе образуются сернистый ангидрид SO2 и оксид магния MgO.
Образование молибдатов магния и кальция в процессе окислительного обжига достигает определенного предела при 427 °С. В связи с этим обжиг молибденового концентрата целесообразно вести при температурах выше 427 °С.
По результатам подсчета изобарно-изотермического потенциала по уравнению Темкина – Шварцмана были получены значения изменения энергии Гиббса от температуры для реакций, которые предположительно протекают при взаимодействии молибденита с доломитом и магнезитом в окислительной среде (таблица).
Результаты расчета значений свободной энергии Гиббса для реакций в зависимости от температуры
|
Предполагаемые реакции |
ΔG0298, кДж/моль |
||||||
|
400 |
500 |
600 |
700 |
800 |
900 |
||
|
1 |
2MoS2 + 3CaMg(CO3)2 + 9O2 → MgMoO4 + + CaMoO4 + 2MgSO4 + 2CaSO4 + 6CO2 |
–2820,6 |
–2772,5 |
–2725,6 |
–2679,7 |
–2634,9 |
–2591,1 |
|
2 |
MoS2 + 3MgCO3 + 4,5O2 → MgMoO4 + + 2MgSO4 + 3CO2 |
–1403,6 |
–1379,8 |
–1355,9 |
–1332,1 |
–1308,2 |
–1259,8 |
|
3 |
MoS2 + 3,5O2 → MoO3 + 2SO2 |
–884,9 |
–864,8 |
–844,8 |
–824,8 |
–804,9 |
–785,1 |
|
4 |
CaMg (CO3)2 → CaCO3 + MgO + CO2 |
1,5 |
–17,0 |
–35,7 |
–54,5 |
–73,2 |
–91,8 |
|
5 |
MgCO3 → MgO + CO2 |
1,13 |
–16,01 |
–32,9 |
–49,7 |
–66,1 |
–82,3 |
|
6 |
MgО + MoO3 → MgMoO4 |
–62,7 |
–64,7 |
–66,9 |
–69,5 |
–72,3 |
–75,4 |
|
7 |
2MgO + 2SO2 + O2 → 2MgSO4 |
–460,9 |
–404,9 |
–349,5 |
–294,5 |
–240,1 |
–186,3 |
|
8 |
MgCO3 + MoO3 →MgMoO4 + CO2 |
–61,6 |
–80,7 |
–99,9 |
–119,1 |
–138,4 |
–157,7 |
|
9 |
CaCO3 → CaO+CO2 |
104,8 |
58,8 |
43,7 |
28,9 |
14,2 |
–0,3 |
|
10 |
CaCO3 + MoO3 → CaMoO4 + CO2 |
–93,7 |
–110,4 |
–127,2 |
–144,2 |
–161,3 |
–178,5 |
|
11 |
CaO + MoO3 → CaMoO4 |
–167,7 |
–169,2 |
–171,1 |
–173,1 |
–175,5 |
–178,2 |
|
12 |
2CaO + 2SO2 + O2 → 2CaMoO4 |
–271,2 |
–232,0 |
–192,9 |
–154,0 |
–115,3 |
–76,9 |
Как видно из таблицы, отрицательные значения изменения свободной энергии Гиббса в исследуемом интервале температур подтверждают возможность протекания реакций с образованием молибдатов и сульфатов магния и кальция в изучаемых системах.
Экспериментальная часть
Процесс окислительного обжига с использованием доломита и магнезита в качестве добавок изучали в лабораторных условиях. Предварительно смешивали молибденовый концентрат с доломитом или магнезитом, затем навеску шихты помещали в электрическую муфельную печь. После обжига огарок взвешивали и проводили рентгенофазовый и химический анализ.
Установлены оптимальные условия окислительного обжига молибденитового концентрата с каждой из минеральных добавок, при которых обеспечивается максимальный перевод молибденита в растворимые формы. При обжиге с магнезитом: температура 600 °С; продолжительность обжига 60 мин; расход магнезита 105 % от стехиометрически необходимого количества для связывания с оксидом молибдена и сернистым газом; при обжиге молибденового концентрата с доломитом: температура 700 °С, продолжительность 60 мин и соотношение концентрат:доломит 1:1,5. Полученные огарки подвергали рентгенофазовому и химическому анализам.
По результатам РФА огарков установлено, что основными конечными продуктами взаимодействий при обжиге с доломитом и магнезитом являются молибдаты и сульфаты магния и кальция, а также оксид молибдена (VI) (рис. 4). По результатам химического анализа при обжиге с доломитом степень улетучивания серы составила 12,3 %, молибдена 1,4 %. При обжиге с магнезитом степень улетучивания молибдена составила менее 1 %, а серы 2,5 %.
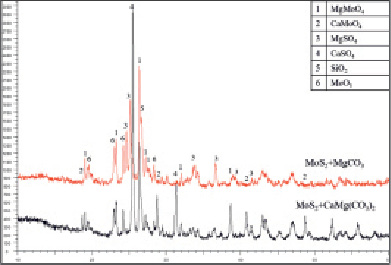
Рис. 4. Рентгенограмма огарков
Таким образом, близкий температурный диапазон термического разложения молибденита и магнезита обеспечил наиболее эффективное взаимодействие продуктов разложения с образованием молибдата и сульфата магния с минимальной потерей оксидов молибдена и серы в газовую фазу.
Выводы
На основании изучения физико-химических свойств исходных материалов и термодинамической оценки взаимодействия молибденита с карбонатами магния и кальция в окислительной среде рассмотрена и обоснована возможность использования дешевых магнийсодержащих соединений природного происхождения – доломита и магнезита в качестве сырьевых добавок при термохимическом разложении молибденита с образованием содорастворимых соединений – MgMoO4 и CaMoO4. Условия процесса обжига молибденита, определенные термодинамическими расчетами, подтверждены экспериментально. Применение природных добавок позволит удешевить процесс обжига молибденита, снизить выбросы сернистого газа в атмосферу. Исходя из результатов работы, выявлено, что использование магнезита в качестве добавки для разложения упорного минерала молибденита более предпочтительно за счет более низкой температуры обжига (600 °С) и меньших потерь серы (2,5 %) и молибдена (менее 1 %) с газовой фазой.



