Известные представления о формировании структуры при кристаллизации металлов и сплавов опираются на работу Таммана [1], где показано, что при малых значениях переохлаждения число центров кристаллизации незначительно, а скорость роста кристаллов достаточно велика. В этих условиях формируется крупнозернистая структура металла. При больших значениях переохлаждения, образуются большое число центров кристаллизации, и при малой скорости роста кристаллов формируется мелкозернистая структура. Необходимо отметить, что указанные представления относятся к «объемной» кристаллизации, а в случае направленной кристаллизации отливок или кристаллизации сварных швов, когда затвердевание идет от твердой подложки, предлагаемый механизм не столь очевиден. Это связано с неопределенностью понятий поверхность раздела фаз и центр кристаллизации при направленном затвердевании.
В литературе [2] приведены сведения о строении границы раздела фаз, которые обозначены, как диффузная и атомно-гладкая поверхности. Энергетически выгодным предполагается диффузная граница раздела фаз, где переход атомов от жидкой фазы к твердой происходит на протяжении нескольких атомных слоев. В пределах этой границы степень упорядоченности атомов возрастает по мере приближения к полностью кристаллической области. Переход атома из жидкой в твердую фазу считается завершенным, когда атом закрепляется в узле кристаллической решетки. Поверхность раздела между атомами твердой и жидкой фаз является условной и неплоской.
При атомно-гладкой поверхности раздела фаз переход атомов из жидкой в твердую фазу должен произойти в области толщиной в один атомный слой. Подобный переход атома жидкой фазы в твердую считается энергетически затратным, поэтому предлагается модель атомно-гладкой поверхности со ступенькой, имеющей излом.
В случае диффузной границы раздела фаз полагают , что на твердой поверхности достаточно энергетически выгодных мест для присоединения атомов жидкой фазы. В этом случае поверхность раздела продвигается в жидкую фазу непрерывно. Для атомно-гладкой поверхности поступательное движение границы слагается из перемещений ступенек, происходящих вдоль поверхности раздела. Отмечается [2], что сама ступень на атомно-гладкой поверхности является «диффузной». В представленных моделях не учитывается электронное строение поверхности раздела фаз, что уменьшает возможность корректного описания процесса кристаллизации.
Известно, что атомы металлов удерживаются в узлах кристаллической решетки за счет перекрывания p, d и f-электронов (сильная σ-связь) и антипараллельности их спинов (слабая π-связь) [3]. Тогда поверхность твердой фазы, представляет из себя атомы, связанные с решеткой, но имеющие свободные p, d и f-электроны со стороны жидкой фазы. Причем p, d и f-электроны соседних атомов на поверхности твердой фазы ориентированы таким образом, чтобы их спины были антипараллельны (рис. 1).
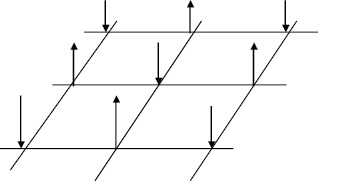
Рис. 1. Ориентация спинов на поверхности твердой фазы
Подобное условие налагается и к сопряженным атомам жидкой фазы. Однако в начальный момент поверхность жидкой фазы не когерентна с твердой, поэтому необходимо различать две поверхности на межфазной границе. Поверхность твердой фазы более консервативна по отношению к жидкой и обозначена, как матричная. Атомы жидкой фазы имеют большую подвижность, по сравнению с поверхностными атомами твердой фазы и здесь следует ожидать развития сопряженной поверхности жидкой фазы. В отличие от матричной поверхности назовем ее поверхностью отклика.
Упорядочивание поверхности отклика вероятно происходит в несколько стадий. В начальной стадии поверхности матрицы и отклика не когерентны (рис. 2).
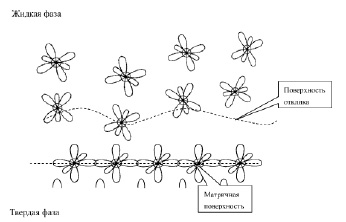
Рис. 2. Начальная стадия упорядочивания поверхности отклика
Развитие поверхности отклика заключается в спиновом упорядочивании атомов жидкой фазы. Атомы жидкой фазы, находящиеся на поверхности отклика совершают колебания, амплитуда которых позволяет образовать σ-связь с атомом на матричной поверхности. Однако, если атом жидкой фазы не имеет пространственную ориентацию обеспечивающую образование π-связи с соседними атомами, то в результате вращательных движений связь с матрицей будет нарушена. Таким образом, на начальной стадии упорядочивания атомы, находящиеся на поверхности отклика должны обеспечить ориентацию спинов, требуемую матрице.
На следующей стадии спиновое упорядочивание распространяется вглубь жидкой фазы, при этом возрастает количество σ-связей, причем следует ожидать уменьшения шероховатости поверхности отклика. Заключительной стадией сопряжения поверхностей должно стать образование между ними кооперированных σ-связей при условии спинового упорядочивания поверхности отклика и прилегающего участка жидкой фазы.
При кристаллизации мы имеем колебательную систему, состоящую из трех элементов. Твердое тело с наименьшей температурой, амплитудой и периодом колебаний. Граница раздела фаз с наибольшей амплитудой и частотой колебаний. Жидкая фаза со средней амплитудой и частотой. Между частями системы осуществляется обмен энергией. В связи с тем, что колебания атомов при кристаллизации происходят при звуковых частотах, вероятней всего, передача энергии носит дискретный характер, соответствующий фононным взаимодействиям.
Исходя из дискретного характера обмена энергией в работе [4] предложена термодинамическая модель периодической кристаллизации, где угловая частота перемещения межфазной поверхности зависит от удельного значения потенциала Гиббса. Выражение, описывающее скорость кристаллизации (V), имеет вид:
V = L ω cos (ω t) + ω0; (1)
здесь, ω = (G/M d2 )0,5 – угловая частота,
где G – значение изобарного потенциала 1-го моля, кДж; M – масса моля; d – толщина кристаллизующегося слоя, м.
L и ω0 – произвольные величины, соответственно линейная и угловая.
В соответствии с выражением (1) угловая частота ω зависит от значения изобарного потенциала. Структура изобарного потенциала представлена выражением
ΔG = ΔH – ΔST – μ Δn – σ ΔF, (2)
где DG – изменение изобарного потенциала; DH – изменение энтальпии при кристаллизации; S –энтропия системы; ∆T – изменение температуры; m – химический потенциал; ∆n – изменение количества вещества; σ – поверхностная энергия; ΔF – изменение площади поверхности раздела фаз.
Выражение (1) использовано для построения фазовых траекторий, описывающих процесс кристаллизации модельного сплава (рис. 3).
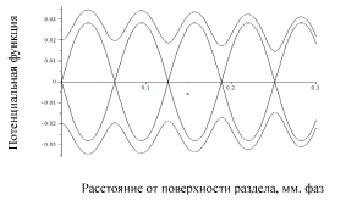
Рис. 3. Фазовый портрет процесса кристаллизации
Фазовый портрет процесса кристаллизации построен по методике, описанной в литературе [4] и включает два типа траекторий. Замкнутые траектории окружают особые точки типа «Центр» с координатами Y=0, Х=2nπ, которые характеризуются минимальным значением потенциала Гиббса. Точка типа «Седло» или точка бифуркации имеет координаты Y = 0, Х = (2n–1)π и соответствует максимуму потенциала Гиббса. Устойчивый процесс кристаллизации имеет место вокруг точек типа «Центр», при увеличении потенциала Гиббса процесс смещается к точке типа «Седло». При этом процесс кристаллизации становится неустойчивым и описывается незамкнутыми (убегающими) фазовыми траекториями [5, 6, 7]. Таким образом, фазовый портрет процесса кристаллизации указывает на то, что выделение скрытой теплоты кристаллизации, упорядочивание структуры, перераспределение в системе вещества, образование новых поверхностей приводят к неравномерному распределению свободной энергии. Отметим, что существует определенный диапазон значений от минимума (центр) до максимума (седло) потенциала Гиббса, в котором процесс кристаллизации протекает устойчиво. В пространстве точки типа «Седло» образуют сферу, а точки типа «Центр» образуют центры сфер, что позволяет представить области устойчивой кристаллизации на плоскости в виде прилегающих друг к другу окружностей. Применительно к реальному строению металлов и сплавов следует отметить, что на различных уровнях структуры имеют место аналогичные округлые формообразования (зерна, блоки и др.). Анализ фазового портрета процесса кристаллизации показывает, что наличие в затвердевающем металле центров с минимумом свободной энергии, совпадение межосевого расстояния кристаллитов с периодом их роста позволяет предположить, что эти точки могут быть центрами кристаллизации для отливок с направленным затвердеванием и сварных швов. Следствием анализа фазового портрета процесса кристаллизации является также то, что затвердевание на сферической поверхности, являющейся геометрическим местом точек типа «Седло» происходит в условиях неустойчивого равновесия, характерных для точек бифуркации. Здесь, равновероятным является как затвердевание, так и плавление.
Выводы
Электронное строение поверхности раздела фаз налагает условие кооперативного упорядочивания атомов жидкой фазы перед их переходом в твердую фазу.
Периодичность процесса кристаллизации обусловлена необходимостью упорядочивания атомов жидкой фазы и особенностями обмена энергией между поверхностью раздела и фазами.
Анализ фазового портрета термодинамической модели периодической кристаллизации показал, что затвердевание структур округлой формы начинается от центров с минимальной свободной энергией и устойчиво до точек бифуркации, располагающихся по сфере или границам зерен, где в силу максимального значения свободной энергии и неустойчивого равновесия равновероятно плавление или затвердевание.



