Введение.
Согласно существующим представлениям, процессы интеркаляции представляют собой обратимые топотаксиальные химические реакции, в которых происходит внедрение молекул «гостей» (атомов, ионов) в матрицу твердого тела. Интерес к этим процессам связан с возможностью синтеза новых соединений, обладающих комплексом физико-химических свойств, которые, зачастую, трудно или невозможно получить с помощью традиционных химических методов синтеза. Поэтому поиск и создание новых интеркаляционных систем (матрица хозяина + молекулы «гостей»), исследование механизма образования и выявление областей их использования представляет несомненный научный и практический интерес.
Анализ многочисленных литературных данных по интеркаляционным системам, содержащим самые разнообразные матрицы и «гостевые» молекулы показывает, что характерной особенностью процесса интеркаляции в слоистые структуры является внедрение гостевых молекул в межслоевое пространство. Это приводит к тому, что в одну и ту же слоистую матрицу, как правило, могут интеркалировать достаточно различные по размерам и геометрии молекулы, т.е. отсутствует молекулярно-ситовой эффект.
Такое представление о процессах образования интеркаляционных соединений слоистого типа определяет сложившиеся методы поиска и создания новых интеркаляционных систем, изучение их физико-химических свойств и возможные области использования этих соединений. Так, например, относительная легкость внедрения в межслоевое пространство гидратированного диоксида титана различных ионов представляет научный интерес по созданию структур с регулируемым составом и величиной межслоевого пространства, которые представляют интерес в качестве неорганических сорбентов с селективными ионообменными свойствами.
Экспериментальная часть.
Образцы сорбентов были синтезированы на основе четырёххлористого титана методом прямого осаждения гидроксидом аммония. В качестве интеркалятов использовали гидроксиды лития, калия и натрия. Условия синтеза представлены в табл.1.
Таблица 1
Условия синтеза сорбентов
|
№ образца |
VNH4OH:VLiOH |
VNH4OH:VKOH |
VNH4OH:VNaOH |
Выход, г |
|
1 |
0:1 |
- |
- |
8,24 |
|
2 |
1:3 |
- |
- |
8,11 |
|
3 |
1:2 |
- |
- |
8,63 |
|
4 |
- |
0:1 |
- |
10,15 |
|
5 |
- |
1:3 |
- |
15,51 |
|
6 |
- |
1:2 |
- |
13,48 |
|
7 |
- |
- |
0:1 |
9,33 |
|
8 |
- |
- |
1:3 |
9,78 |
|
9 |
- |
- |
1:2 |
10,02 |
|
10 |
Осаждался NH4OHконц |
6,95 |
||
Талица 2
Химический состав полученных сорбентов
|
№ сорбента |
Количество Ti, моль/г сорбента |
Количество щелочного металла, моль/г сорбента |
Соотношение Ti:Me+ (Li, K, Na) |
|
1 |
4,51∙10-3 |
7,28∙10-4 |
6,2:1 |
|
2 |
2,40∙10-3 |
4,01∙10-4 |
6,0:1 |
|
3 |
1,70∙10-3 |
2,71∙10-4 |
6,3:1 |
|
4 |
4,71∙10-3 |
7,47∙10-4 |
6,3:1 |
|
5 |
2,05∙10-3 |
3,40∙10-4 |
6,05:1 |
|
6 |
1,96∙10-3 |
3,22∙10-4 |
6,1:1 |
|
7 |
4,50∙10-3 |
7,62∙10-4 |
6,2:1 |
|
8 |
2,39∙10-3 |
3,80∙10-4 |
6,3:1 |
|
9 |
2,01∙10-3 |
3,30∙10-4 |
6,1:1 |
|
10 |
5,00∙10-3 |
- |
- |
Полученные соотношения Ti:Me+ указывают на то, что ионы щелочных металлов встраиваются в межплоскостное пространство таким образом, что образуются своего рода октаэдры. Нецелочисленность значений полученных соотношений говорят об искажении структуры вследствие интеркаляции чужеродных ионов.
Анализ сорбентов проводили на приборе «Дрон-3» с использованием рентгеновского излучения С0Кα. На основании рентгенограмм все образцы имеют аморфную структуру.
ИК – спектры для 2, 5, 8, 10 сорбентов на основе ГДТ (IV) представлены на рис. 1 и 2. Спектры были сняты в области от 500см-1 до 4000см-1. В спектрах всех образцов в области поглощения ν(ОН) колебаний 3800…2600 см-1 наблюдается широкая интенсивная полоса. В области поглощения δ(Н2О) колебаний в спектрах наблюдаются группы полос с максимумами 1696, 1685 и 1656 см-1, указывающих на разнообразие энергий взаимодействия молекул воды с элементами структуры гидратированного диоксида.
В спектрах присутствуют полосы с максимумами 1696 и 1685 см-1, которые могут служить аналитическими на присутствие в структуре TiO2 иона гидроксония Н3О+. Полосу поглощения при 1403 см-1 у всех образцов можно отнести к мостиковым колебаниям δ(≡Ti-O(H)-Ti≡). Колебания ν(TiO) октаэдра TiO6 проявляются в спектрах в виде широкой диффузионной полосы поглощения в области 900…500 см-1, имеющей несколько максимумов, что указывает на сильное искажение титан-кислородного октаэдра в структурах соединений.
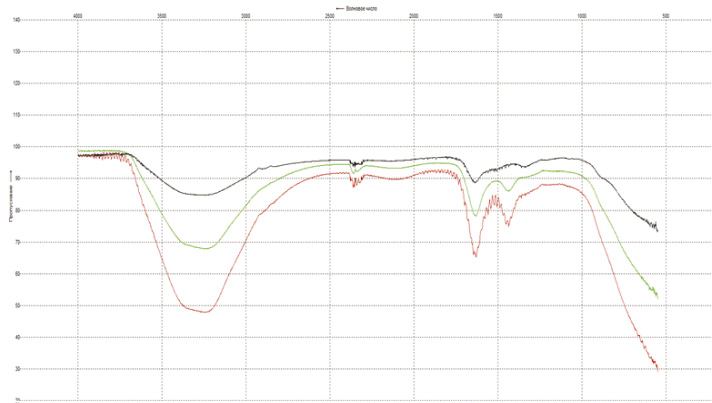
Рис. 1. ИК-спектры образцов, интеркалированных литием (№2), калием (№5), натрием (№8)
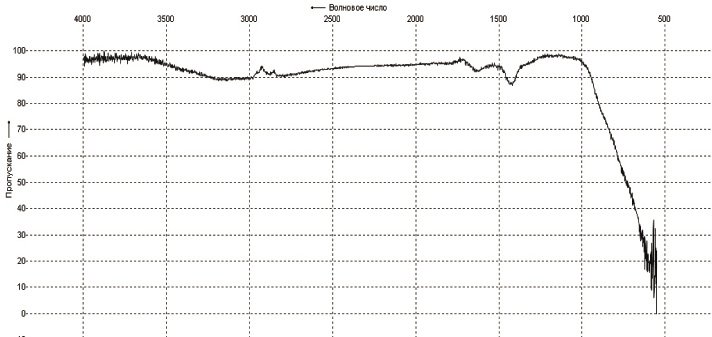
Рис.2. ИК-спектр гидратированного диоксида титана
Особенности структуры ионитов проявляются и в результатах термогравиметрического исследования. Общий вид полученных термограмм интеркалированных образцов аналогичен. Результаты термогравиметрического анализа показали, что в образцах при Т=120°С уходит 10-20% адсорбционной воды, при Т=250°С уходит 30-40% кристаллизационной воды и при Т=330°С уходит 17-25% конституционной влаги. При температуре свыше 400°С потери массы не происходит. Таким образом, был доказан гидратированный характер полученных сорбентов.
Первым этапом исследования сорбционной способности стало определение оптимального времени сорбции, рН растворов, а так же выявление рядов селективности. Из полученных данных было определено оптимальное время контактирования сорбента с раствором, которое составило 7 часов; и оптимальное значение рН исходных растворов, которое составляет 6,5-8.
Ряды селективности для щелочных металлов: Rb+>K+>Na+>Li+ (ГДТ); K+>Na +> Rb+>Li+ (ГДТ, интеркалированный Li+); Rb+>Na+>Li+>K + (ГДТ, интеркалированный К+); K+>Rb+>Li+>Na+ (ГДТ, интеркалированный Na+). По отношению к переходным металлам все полученные сорбенты обладают высокой сорбционной способностью.
Кислотно-основные свойства гидратированного диоксида титана являются основными параметрами для их применения в качестве ионообменника. Для установления количества и типа функциональных групп, входящих в состав полученных сорбентов, а также рабочей области рН процесса сорбции использован метод потенциометрического титрования в системе Н+/Na+ (К+) способом отдельных навесок. Кривые титрования образцов имеют классический вид. Полученный характер зависимости можно интерпретировать следующим образом. При добавлении первых порций титранта происходит сорбция ионов калия (или натрия), при которой ионы гидроксония из сорбента выделяются в раствор и нейтрализуются введением гидроксид-ионов – первый участок на кривых. Резкое изменение рН связано с избыточной концентрацией основания. При этом происходит скачок в значении рН – второй участок. При дальнейшем добавлении основания рН практически не изменяется – третий участок. На этом участке сорбция ионов не наблюдается. По полученным кривым были рассчитаны рК образцов. Значения рК для полученных сорбентов колеблются от 8,5 до 9,0.
Исходя из полученных данных, уравнение ионного обмена можно представить следующим образом:
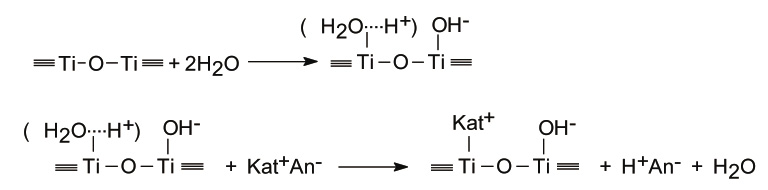
Были оценены параметры кинетики, на основании которых построены кинетические кривые. Кинетические кривые состоят из двух стадий: первому участку соответствует пленочная или внешняя диффузия, она протекает на поверхности гранул, это быстрая стадия. Второму участку соответствует гелиевая или внутренняя, диффузия внутрь сорбента, это медленная стадия, определяющая скорость обменных процессов.
Выводы.
1. Осуществлен синтез гидратированного диоксида титана (IV) методом прямого осаждения при различных объёмных соотношениях осадителей.
2. Комплексом физико-химических методов (рентгеноструктурный анализ, ИК-спектроскопия, термогравиметрия) исследовали структуру синтезированных образцов. При введении интеркалята структура сорбентов искажается, а сорбционные свойства увеличиваются. Синтезированные образцы являются катионитами.
3. Определены оптимальные условия сорбции (рН=6,5-8, время контактирования 7 часов).
4. Проведенные исследования могут служить основой для разработки новых методик по разделению близких по свойствам металлов и их концентрированию.



