Анализ современных методов промышленного синтеза карбамида показал, что процесс основан на реакциях А.И. Базарова. В настоящее время наиболее признаны и широко применяются замкнутые схемы производства карбамида с полным возвратом в процесс непрореагировавших NH3 и CO2. Из всех известных способов получения карбамида промышленное значение получил процесс синтеза карбамида из аммиака и диоксида углерода по схеме со стриппинг-процессом. Метод получения карбамида основан на взаимодействии аммиака и двуокиси углерода в жидкой фазе. При этом основной процесс протекает в колонне синтеза в две стадии:
– превращение аммиака (NH3) и двуокиси углерода (СО2) в карбамат аммония (NH4СООNH2)
2 NH3 + СО2 ↔ NH4СООNH2 + 125,6 кДж; (1)
– дегидратация карбамата аммония и образование карбамида (CO(NH2)2)
NH4СООNH2 ↔ CO(NH2)2 + Н2О – 15,5 кДж. (2)
В условиях синтеза протекают процессы образования карбамата аммония, карбамида, разложения карбамата аммония, а также образования углеаммонийных солей (УАС).
Характерной особенностью данной технологии является применение стриппинг-процесса для дистилляции плава под давлением синтеза. Стриппинг-процесс – это процесс разложения карбамата аммония, непрореагировавшего в карбамид, при давлении синтеза путем подогрева и подачи в раствор, выходящий из колонны синтеза, диоксида углерода.
Все представленные реакции являются обратимыми, следовательно, равновесие каждой из них находится в зависимости от определенных условий. Рассмотрим влияние различных факторов на процесс синтеза карбамида.
Основное условие образования карбамида из карбамата аммония является наличие последнего в жидком состоянии. Из этого следует, что реакция должна протекать только при высоких температурах (T), по крайней мере, не меньших, чем температура плавления карбамата.
Результаты термографических и спектральных исследований позволяют заключить, что синтез карбамида протекает по двум конкурирующим направлениям с преобладанием реакции (2) при низких температурах, реакций (3) и (4) при более высоких температурах.
NH4СООNH2 ↔ NH4СNО + Н2О; (3)
NH4СNО ↔ CO(NH2)2. (4)
Стоит отметить, чем выше температура, тем наиболее эффективно возрастает скорость превращения карбамата в карбамид. Однако значительное увеличение температуры оказывает отрицательное влияние на степень превращения карбамата в карбамид, так как при этом происходит понижение плотности жидкой фазы и стремительное увеличение газовой. К тому же снижение выхода карбамида связано с протеканием побочных реакций в узле синтеза.
В узле синтеза рассматриваемой схемы технологического процесса образование карбамида протекает при температуре 180–189 °С, а следовательно, преобладающей является реакция (2).
При взаимодействии аммиака и двуокиси углерода получается только карбамат аммония независимо от соотношения компонентов NH3 : CO2. В присутствии воды, кроме карбамата аммония образуются карбонаты.
Из анализа влияния температурного режима синтеза карбамида на выход продукта следует, что существенное влияние на процесс оказывает наличие воды. В начале нагревания карбамата скорость реакции, особенно при высоких температурах, весьма значительна вследствие положительного действия воды, образующейся в процессе дегидратации. Однако, по мере накопления воды, начинает сказываться ее отрицательное действие и скорости реакции сильно замедляются. Происходит протекание обратной реакции образования карбамата из карбамида и воды. Таким образом, накопление воды в реакционном плаве в результате дегидратации карбамата аммония, а также введение воды с NH3 и СО2 тормозит течение реакции дегидратации карбамата, т. е. приводит к снижению выходов карбамида.
Одним из наиболее удачных приемов, позволяющих предотвратить протекание реакции гидролиза карбамида, является введение в систему избытка аммиака сверх стехиометрического количества, вследствие чего равновесная степень превращения карбамата аммония в мочевину резко возрастает. Опытным путем установлено, что гидролиз карбамида в присутствии свободного аммиака не только замедляется, но при этом создаются условия для ускорения реакции дегидратации карбамата.
С повышением температуры давление диссоциации (P) возрастает весьма интенсивно. При диссоциации твердого сухого карбамата молярное отношение NH3 : CO2 сохраняется одинаковым как в твердой, так и в газовой фазе и давление диссоциации зависит только от температуры. При появлении жидкой фазы, т.е. когда начинается процесс дегидратации, состав реакционного плава будет другой. Изменение состава неизбежно вызывает и изменение свойств. Следовательно, давление процесса будет зависеть не только от одной температуры. Изучение этой проблемы различными учеными показывает, что на величину равновесного давления при одной и той же температуре оказывает степень загрузки реакционного аппарата. Так же стоит отметить, что равновесное давление над плавом карбамида зависит и от величины мольного соотношения NH3 : CO2. При избытке двуокиси углерода давление резко возрастает, при избытке аммиака оно значительно ниже. Давление оказывает большое влияние на степень превращения карбамата аммония в карбамид (с увеличением давления степень конверсии двуокиси углерода в карбамид возрастает) [2]. В узле синтеза анализируемой технологического схемы получение карбамида протекает при давлении 14,9 ÷ 15,4 МПа.
В присутствии инертных газов увеличивается объем газовой фазы в колонне синтеза и уменьшается степень ее заполнения, что приводит к снижению удельной производительности реакционного объема и уменьшения степени превращения СО2 в карбамид. В связи с этим особое внимание уделяется вопросам тщательной очистки и повышения концентрации двуокиси углерода, используемой в синтезе карбамида. Оптимальной концентрацией СО2, используемой в синтезе карбамида, следует принять максимально близкую к 100 %.
Изучая влияние двуокиси углерода на равновесный выход карбамида, установили, что избыток СО2 практически не влияет на превращение карбамата аммония в карбамид. Это подтверждает гетерогенность продуктов реакции синтеза карбамида и ее протекание в жидкой фазе.
Избыток аммиака заметно смещает равновесие реакции синтеза в сторону образования карбамида. При этом уменьшается количество побочных продуктов и коррозия аппаратуры.
Нормировав мольное содержание одного компонента единицей, например 1 моль CO2, L молей NH3, W молей H2O проводят реакцию синтеза карбамида. В результате образуется x молей карбамида, x + W молей воды, останется 1 – x молей NH3, связанных в различных веществах. Брутто-числа молей компонентов будут равны:
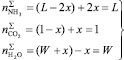 , (5)
, (5)
где L и W – параметры состояния системы наряду с давлением (P) и температурой (T).
До установления равновесия величины L и W численно совпадают с мольными соотношениями NH3 : CO2, H2O : CO2, когда L, W моль исходных аммиака и воды смешивают с 1 моль исходного диоксида углерода при заданных P, T. Поэтому L и W – технологические параметры, управляющие состоянием системы в производственных условиях [1].
При обеспечении оптимального мольного соотношения компонентов степень конверсии СО2 в карбамид приблизительно 60 %.
Оптимальное мольное соотношение компонентов:
NH3 : СО2 : Н2О = (3,2 ÷ 3,6) : 1 : (0,6 ÷ 0,83). (6)
Из вышесказанного следует сделать следующие выводы. Равновесное давление над плавом карбамида, возрастает весьма резко даже при относительно небольшом повышении температуры, что оказывает существенное влияние на протекание синтеза, так как возрастает степень конверсии диоксида углерода в карбамид.
Чрезмерно высокие температуры протекания синтеза карбамида приводят к протеканию побочных реакций, что обуславливает снижение выхода карбамида. Однако стоит помнить, что реакция синтеза протекает при температурах, по крайней мере не меньших, чем температура плавления карбамата.
Наличие жидкой фазы является необходимым условием протекания процесса, в тоже время ее избыток значительно тормозит течение реакции дегидратации карбамида.
Решить сложившуюся проблему позволяет введение избытка аммиака (NH3). Аммиак с одной стороны позволяет предотвратить протекание реакции гидролиза и сместить равновесие в сторону образования продукта, с другой – приводит к снижению равновесного давления [5].
Для получения максимальных выходов карбамида необходимо, чтобы плав находился в аппарате строго определенное время. Поэтому в производственных условиях продолжительность процесса – один из основных технологических параметров. На скорость реакции влияет большое количество различных факторов (температура, давление, мольные соотношения NH3 : СО2 : Н2О, плотность загрузки). Время пребывания плава в реакторе может быть сокращено при подборе соответствующих условий (параметров процесса).
Добиться оптимального сочетания технологических параметров позволит управление на основе математической модели. Под математической моделью понимают приближенное математическое описание какого-либо явления или процесса, выраженное с помощью математической символики. Для реализации управления потребуются достоверные математические модели, способные не только качественно, но и количественно описать такие явления, как равновесные зависимости, перенос тепла и массы между фазами [3].
Общую схему управления на основе математической модели можно представить в виде совокупности трех звеньев: программы с алгоритмом расчета материального и теплового баланса по математическим моделям, контроллера и технологической схемы.
Контроллер принимает данные о технологических параметрах от объекта управления и передает их в программу с алгоритмом расчета материального баланса по математическим моделям. Получив все необходимые параметры, программа начитает расчет по математической модели агрегата получения карбамида. После проведения расчета, программа выдает значения расходов аммиака и воды, которые передаются в контроллер в качестве задания регуляторам соответствующих потоков.
Так как расчет производится по данным, полученным от средств контроля, то немаловажное значение имеет точность измерения технологических параметров процесса. Именно поэтому стоит особое внимание уделить выбору средств измерения температуры, давления, расхода.



