3-Арилметилиден-3Н-пиррол-2-оны, обладающие широким спектром биологической активности, занимают важное место среди органических соединений. С целью синтеза новых потенциально физиологически активных веществ актуальна структурная модификация их производных.
Ранее нами сообщалось о реакциях 5-R-3-арилметилиден-3Н-пиррол-2-онов с таким бинуклеофильным реагентом как 2-меркаптобензимидазол, приводящих к гетероциклам ряда тиазинонов ангулярного строения [1].
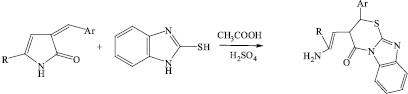
В связи с тем, что соединения, содержащие фрагмент бензимидазола, интересны благодаря разнообразной биологической активности, в настоящей работе в качестве бинуклеофильного реагента использовали 2-аминобензимидазол, имеющий в структуре два неравноценных по нуклеофильности атома азота.
Реакция 5-R-3-арилметилиден-3Н-пиррол-2-онов с 2-аминобензимидазолом проводилась при кипячении реагентов в этиловом спирте в течение 10 часов в условиях основного катализа (в качестве катализатора использовался поташ) при соотношении реагентов 1:1,5, соответственно.
Наличие второго нуклеофильного центра в реагенте определяет возможность взаимодействия по нескольким реакционным центрам, содержащихся в молекуле субстрата.
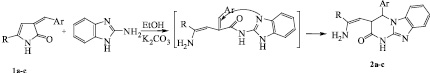
Данные элементного анализа и спектральные характеристики позволяют сделать вывод о строении полученных соединений в виде 3-(2-амино-2-арилвинил)-4-арил-3,4-дигидробензо[4,5]имидазо[1,2-a]пиримидин-2(1H)-онов (2 a-с). Продукты реакции 2a-с выделены с выходом до 81 %.
В ИК-спектрах соединения 2 a-с отмечены полосы поглощения амидной карбонильной группы при 1683-1628 см–1 (амидI), полоса «амидII» при 1577-1529 см–1, колебания ароматических колец 1606-1598 см–1, две полосы поглощения первичной амино-группы в интервале 3465-3212 см–1. В ЯМР1Н-спектрах соединений 2 a-с отмечены дублеты винильного протона в области 6,33-6,67 м.д. и протона при третичном атоме углерода в области 5,10-5,78 м.д., мультиплет протона при третичном атоме углерода расположен в области 3,50-3,79 м.д., синглет протонов NH2 группы отмечен при 8,34-8,46 м.д., синглет NH группы при 4,01-4,37 м.д., сигналы ароматических колец отмечены в областях 6,82-8,11 м.д., также отмечены синглеты метильной группы для соединения 2b при 2,39 м.д., группы –N(CH3)2 соединения 2c при 3,05 м.д. В спектрах ЯМР13С соединения 2c в сильном поле отмечены сигналы sp3-гибридных атомов углерода при 31,88; 32,92 м.д., сигнал метильных групп фрагмента –N(CH3)2 при 39,99 м.д., сигналы атомов углерода енаминового фрагмента при 98,63 м.д. и при 151,29 м.д. (углерод, связанный с аминогруппой), сигнал карбонильной группы отмечен при 171,89 м.д., серия сигналов ароматических атомов углерода находятся в области 110,69-141,41 м.д.
Схема реакции предполагает первоначальную атаку нуклеофильного центра 2-аминобензимидазола по карбонильной группе пиррол-2-онового фрагмента, что сопровождается раскрытием гетероцикла.
Таким образом, в результате реакции 5-R-3-арилметилиден-3Н-пиррол-2-онов с 2-аминобензимидазолом получены новые полигетероциклические соединения – замещенные имидазопиримидиноны линеарного строения.
Экспериментальная часть
ИК – спектры записаны на приборе ИК фурье-спектрометре ФСМ-1201 в таблетках KBr, спектральный диапазон – 400-4000 см–1. Спектры ЯМР1Н получены на спектрометре Varian-400, при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 400 МГц. Спектры ЯМР1Н получены на спектрометре Varian-400, при 20-25 °С в CDCl3, внутренний стандарт ТМС. Рабочая частота 100 МГц.
3-(2-Амино-2-арилвинил)-4-арил-3,4-дигидробензо[4,5]имидазо[1,2-a]пиримидин-2(1H)-оны 2 a-с. Смесь 0,010 моль 5-R-3-арилметилиден-3Н-пиррол-2-она (1а-с) и 0,015 моль 2-аминобензимидазола кипятят в этиловом спирте в течение 10 часов, с каталитическим количеством карбоната калия, выливают в холодную воду, нейтрализуют раствором соляной кислоты. Выпавшие кристаллы отфильтровывают, перекристаллизовывают из этилового спирта.
2a: Выход: 77 %, Тпл, °С 99-97 °С. Найдено: С, 75.21; Н, 5.00; N, 15.03;. C24H20N4O. Вычислено С, 75.77; Н, 5.30; N, 14.73. ЯМР1Н (400 MHz, CDCl3): d 6,41-6,45 (д, 1Н, = СН); 5,75-5,78 (д, 1Н, СН); 3,53-3,70 (м, 1Н, СН); 8,34 (с, 2Н,NH2), 4,01 (c, 1H, NH), 6,97-7,91 (м, 14Н, Ar).
2b: Выход: 81 %, Тпл, °С 224-225 °С. Найдено: С, 69.58; Н, 4.78; N, 13.31;. C25H21СlN4O. Вычислено С, 70.01; Н, 4.90; N, 13.06. ЯМР1Н (400 MHz, CDCl3): d 6,33-6,35 (д, 1Н, = СН); 5,26-5,29 (д, 1Н, СН); 3,51-3,69 (м, 1Н, СН); 8,46 (c, 2H, NH2); 4,37 (c, 1H, NH); 6,82-7,94 (м, 12 H, Ar); 2,39 (с, 3H, CH3).
2c: Выход: 68 %, Тпл, °С 151-152 °С. Найдено: С, 73.70; Н, 5.55; N, 16.03;. C26H25N5O. Вычислено С, 73.74; Н, 5.95; N, 16.54. ЯМР1Н (400 MHz, CDCl3): d 6,65-6,67 (д, 1Н, = СН); 5,10-5,12(д, 1Н, СН); 3,50-3,60 (м, 1Н, СН); 8,41(с, 2Н, NH2); 4,10 (с, 1Н, NH); 6,97-8,05 (м, 13H, Ar); 3,05 (c, 6H, N(CH3)2).. ЯМР13С (100 MHz, CDCl3,): d 31,88; 32,92; 39,99; 98, 63; 110,69-141,41; 151,29; 153,50; 171,89
Работа выполнена при финансовой поддержке РФФИ (Грант 10-03-00640- а) и гранта Президента РФ для государственной поддержки молодых российских ученых № МК-2054.2011.3.



