Резюме. У 80 женщин с хроническим панкреатитом исследовано состояние апоптотической реакции с оценкой экспрессии Fas (CD95) лимфоцитов на основе учёта клеток-участников апоптоза CD4, CD8, CD16 (NK), CD25-№T2 и основных цитокинов ИЛ-ip, ИФН-у, ФНО-а в зависимости от тяжести течения и формы заболевания. Установлены колебания клеток-участников апоптоза в диапазоне значимых повышений клеток- участников апоптоза и уровня цитокинов, преимущественно ФНО-а .
Апоптоз, являясь ключевым механизмом иммунорегуляции запрограммированной гибели клетки, обеспечивает баланс между клетками и сохранением функции (Ярилин А. А., 1996; Ritas, 1999; Kovatuashi H., Ouchi N., Kiharas J. et al., 2004). Усиление апоптоза клеток становится предиктором иммунной недостаточности, прогрессирования заболевания, чему способствуют наркотоксиканты, в частности, алкоголь.
Апоптотический эффект зависит во многом от медиаторов межклеточного взаимодействия, в частности, цитокинов. Провоспалительные цитокины ФНО-а, ИЛ-1Р, ИЛ-6) и иммунорегулирующие как ИФН- у усиливают продукцию и увеличивают выраженность воспалительных процессов (Jracey K.J., Cerami A., 1994); Veres A., Pro-haszka L., Kilpinen S. et al., 2002; Wong B.R., Josien R., Lee S.V. et al., 1997), где ФНО-а является мощным индуктором апоптоза клеток, а апоптотические клетки, которые не стали жертвой быстрого фагоцитоза, начинают выделять цитокины (Mohamed- Ali V., Goodrick S., Bulmer K. et al., 1999; Krown K.A., Page M.T., Ngueyen C. et al., 1996; Kumar A., Jnota V., Dee L. et al. 1996).
В апоптотической реакции принимают участие многие клеточные механизмы, среди которых важное значение имеют кластерные варианты лимфоцитов с их распознающими механизмами CD16(NK), активационным назначением (СД25 и СД8) и сигнальной системой (СД95- Fas), где сигнальная функция на всем протяжении апоптической реакции и, особенно, на заключительном этапе принадлежит СД95 (Fas- апоптоз) лимфоцитам.
Все перечисленные клетки и цитокины в совокупности становятся ответственными за рост, дифференцировку клеток организма, распознавание и уничтожение трансформированных и отживших клеток.
В настоящее время изучается реакция апоптоза при артериальной гипертонии, атеросклерозе (Шляхто Е.М., Моисеева О.М., 2008; Nazobi C., 2003). В связи с этим, анализ апоптотической реакции при хроническом панкреатите, занимающем важное место в социальном статусе, поражая лиц трудоспособного возраста, становится актуальным в отражении уровня здоровья.
Целью работы явилось изучение реакции апоптоза и участников клеточного и цитокинового комплекса у больных хроническим панкреатитом.
Материал и методы. Проведено обследование 80 женщин с хроническим панкреатитом с различной степенью тяжести. В качестве материала исследования служила кровь. В материалах определяли содержание лимфоцитов, причастных к апоптозу - CD4, CD8, CD16, CD25, СД95 (Fas) и HLA-DR, а также активность цитокинов в сыворотке крови методом твердофазного ИФА с набором диагностических систем.
Результаты исследования.
Оценка содержания лимфоцитов в периферической крови - клеток-участников апоптоза выявила определенные изменения, которые характеризовались у больных хроническим панкреатитом относительной Т-лимфоцитопенией, снижением CD4+- Т-лимфоцитов, В- лимфоцитозом (табл.1).
Отмечено увеличение содержания лимфоцитов, экспрессирующих рецептор к ИЛ2 (СБ25). При легком течении наблюдалась тенденция к повышению, при среднетяжелой степени уже отмечалось статистически значимое увеличение на 23,9% (р=0,046) по отношению к группе контроля, а при тяжелом течении показатель увеличился на 41,6% по отношению к контролю (р=0,001) и на 29,0% (р=0,036) - к группе с легким течением. Увеличение содержания СБ25+- Тлимфоцитов свидетельствует об активации Т и В лимфоцитов.
Отмечена отчетливая тенденция к снижению CD4- лимфоцитов, однако значимость была выявлена в группах со средним и тяжелым течением (р=0,038).
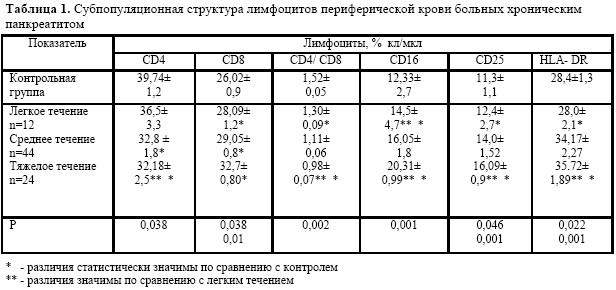
Повышение цитотоксических лимфоцитов СD8 носило выраженный характер с высокой степенью достоверности. При легком течении этот показатель повышался на 7,9%, в группе больных со средней тяжестью - на 25,9% (р=0,038). Уровень рецепторов JgG CD16, опосредующих антителозависимую цитотоксичность, повышался на 17,8%, 33,2% и 66,2% (р=0,01) по отношению к контрольной группе соответственно с возрастанием тяжести заболевания. Содержание лимфоцитов, экспрессирующих антиген гистосовместимо-сти (HLA-DR), также возрастало значимо при среднем и тяжелом течении хронического панкреатита. Это подтверждается наличием прямой корреляционной связи с амилазой (г=0,41; р=0,048). Антигены HLA2 класса при наличии воспаления появляются на поверхности клеток, что приводит к ее дисфункции.
Эти изменения закономерно дополняют картину угнетения Т-клеточного звена с повышением выработки цитотоксических клеток и натуральных киллеров (CD16) и отражают вялотекущий процесс воспаления.
Значимое снижение уровня CD4 хелперов и повышение CD8^TO закономерно приводит к уменьшению иммунорегуляторного индекса (CD4/CD8), который при тяжелом течении составил 0,98±0,07 против 1,52±0,05 в контрольной группе (р=0,002). Значительное снижение иммуно-регуляторного индекса и повышение CD8 + Т-лимфоцитов свидетельствует о длительно текущем воспалении.
Наряду с выраженным Т-субпопуляционным дисбалансом в периферической крови больных ХП наибольшие отклонения обнаружены в CD16(NK) лимфоцитах на фоне повышенной величины со стороны клеток, экспрессирующих антиген гистосовместимости 2 класса - HLA-DR.(Рис.1)
Наличие гиперэкспрессии HLA-DR-маркера на активированных клетках и неспецифический характер взаимодействия NK- клеток с клеточными мишенями позволяет предположить наличие аутоиммунных повреждениях поджелудочной железы.
Активация иммунной системы подтверждается повышенной экспрессией низкоафинного рецептора CD25 к ИЛ-2.
Параллельно с анализом субпопуляционной структуры лимфоцитов у больных ХП и здоровых доноров (контроль) была произведена оценка содержания лимфоцитов в периферической крови, экспрессирующих Fas, при использовании МКА против Fas-клона DX-2. Так, Fas экспрессируется на многих типах клеток Т-лимфоцитов, в меньшей степени В-лимфоцитах, его экспрессия усиливается при активации клеток (Sibiryak S., 1999; Moller P. et al., 1996).
Мембраноассоциированный Fas (М FasL) -гликопротеин, относящийся к семейству ТОТ (Suda J. et al. 1994; Nagata S., Golstein P., 1995), экспрессируется на более ограниченном числе клеточных типов - активированных CD8+- лимфоцитах, CD4+- лимфоцитах и NK- клетках. Взаимодействие Fas - рецептора происходит при переходе его из фазы покоя в фазу клеточного цикла и необходимо для митотической активности клетки. FasR (CD95) лишь отражает готовность клеток к рецепции апоптогенного сигнала (Belka C., 1998).
Уровни клеток CD95(Fas) были наиболее благополучны, не опускаясь ниже нормальных величин (контрольной группы).
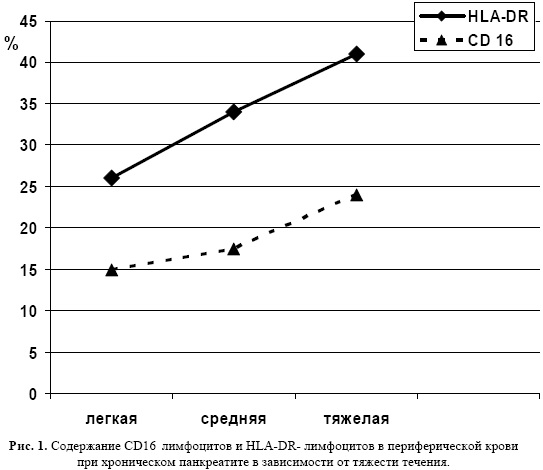
Оценка уровня СD25+ Т-лимфоцитов установила его повышение у больных ХП с увеличением тяжести состояния. Полученные значения в группе с легким течением превышают контрольные показатели на 10,2% (р=0,246), при средней степени - на 156,3% (р=0,001) и при тяжелом течении -на 154,3% (р=0,001). (Рис.2).
Оценка уровня CD95(Fas) лимфоцитов выявила высоко значимое его повышение в группах больных ХП. Проведенный корреляционный анализ показал взаимосвязь между уровнем CD95 (Fas) и показателями цитокинов: ИЛ-1Р (r =0,882, р=0,01), ФНО-а (r = 0,981, р=0,001) и ИФН-у (r = 0,478, p=0,038) и обратную связь с CD4 (r =-0,039, p=0,01).
Наши данные отразили увеличение уровня провоспалительных цитокинов при всех формах заболевания и тяжести течения (табл.2). Высоко значимое повышение ИЛ-1р отмечено у больных ХП средней тяжести (р=0,001), наименьшее - в группе с легким течением (р=0,038). Уровень ИФН-у по своему содержанию мало отличался от показателей контрольной группы, достоверно превышая их только при тяжелом течении (р=0,032).
Наиболее выраженной была экспрессия ФНО-а во всех обследованных группах, превышая контрольные величины в 3-5 раз. Если учесть, что основной путь инициации апоптоза реализуется через систему мембрано-связанных белков семейства туморнекротических (ФНО) рецепторов, то стимуляция ФНО-а, безусловно, запускает целый каскад реакций, способствующих повреждению поджелудочной железы вследствие повышения воспаления и локальной ишемии.

Таким образом, можно предположить, что основной вклад в суммарную гибель клеток железы при ХП вносит апоптотическая реакция, нарушая её функцию, где ФНО-а становится мощным индуктором апоптоза клеток. На это указывает высокая корреляционная взаимосвязь ^95(Fas)-Т лимфоцитов с активностью ФНО-а (р=0,001), где повышение уровня ФНО-а становится ответственным за тяжесть течения заболевания. Это не исключает существующую связь между ФНО-а с апоптозом и дисфункцией поджелудочной железы. Выявленная взаимосвязь содержания СД95 (Fas) лимфоцитов и ФНО-а периферической крови у пациентов ХП может повысить диагностическую значимость определения экспрессии Fas и ФНО-а, а их уровни могут приобретать и прогностическую значимость, позволяя предвидеть развитие осложнений, явиться дополнительным методом для прогноза тяжести заболевания.
Заключение.
Для хронического панкреатита характерна высокая готовность к удалению нежизнеспособных клеток, их обновлению, замене и дифференцировке в процессе апоптотической реакции. Это хорошо обеспечено клетками-участниками CD4, CD8, CD16(NK), CD254UL2, CD95 (Fas) и необходимыми цитокинами: ИЛ-1Р, ИФН-у, ФНО-а.
СПИСОК ЛИТЕРАТУРЫ:
1. Ярилин А.А. Апоптоз и его место в иммунном процессе // Журн. Иммунология- 1996; 6: 10-20.
2. Шляхто Е.М., Моисеева О.М. Ремоделирование сосудов и реакция апоптоза при артериальной гипертонии // Артериальная гипертензия, 2008-3: 12-18.
3. Krown K.A., Page M.T., Nguyen C. et al. Tumor necrosis factor alpha-induced apoptosis in cardiac myocytes: involvement of the sphingolipid signaling cascade in cardiac cell death // J. Clin. Invest.-1996;98: 2854-2865.
4. Kobayashy H., Ouchi N., Kiharas et al. Selective suppression of endothelial cell apoptosis by the high molecular weight form of adiponectin // Cli. Res.-2004; 94: 27-31.
5. Kumar A., ТЬ-ota V., Dee L. et al. Tumor necrosis factor and interleukin- 1 beta are responsible for in vitro myocardial cell depression induced by human septic shock serum // J. Exp. Med. - 1996;183:949-958.
6. Mohamed-Ali V., Goodrick S.,
Bulmer K. Production of soluble tumor necrosis factor receptors by human subcutaneous adipose tissue in vivo //
Am. J. Physiol. - 1999; 277: 971-975.
7. Rifas L. Bone and cytokines: beyond IL-1, IL-6 and TNF-a // Calcif. Tissue Int. - 1999; 64: 1-7.
8. Tracey K.J., Cerami A. Tumor necrosis factor: a apheliotropic cytokine and theurapeutic agent // Ann. Rev. Immunol. - 1994; 45: 491-503.
9. Sibiryak S., Yusupova R., Kayumova E. Antigen expression on the peripheral blood lymphocytes in healthy donors and pulmonalis tuberculosis patient // Russ. J. Jmmunol. - 1999; 1: 34-42.



