Введение
Стволовые клетки - источник образования всех клеток и тканей организма. Источниками стволовых клеток могут служить костный мозг, мобилизированная периферическая кровь и пуповинная кровь.
Возможность использования пуповинной крови в качестве источника получения стволовых клеток впервые была предложена E.Boyse в 1983г. Последующие эксперименты на облучённых мышах выявили, что в крови новорожденных мышей содержится достаточное количество гемопоэтических прогениторных клеток для восстановления костного мозга облучённых животных. Первый банк стволовых клеток пуповиной крови был образован при университете Индианы для сохранения стволовых клеток сиблингов детей, нуждающихся в донорской трансплантации [22]. Используя один из образцов банка, Gluckman et al впервые трасплантировали гемопоэтические стволовые клетки 6-ти летнему ребёнку, страдающему анемией Фанкони (1988г.) [16].
К настоящему времени по всему миру произведено более 2000 родственных и более 400 неродственных трансплантаций стволовых клеток, как детям, так и взрослым. Перечень показаний к трансплантации стволовых клеток пуповинной крови становится всё более обширным.
Пуповинная кровь как источник стволовых клеток отличается тем, что содержит большее число примитивных гемопоэтических клеток-предшественников, которые имеют более высокую пролиферативную способность и меньшую склонность к возникновению реакции «трансплантант-против-хозяина» при пересадке [3,16,21]. Это значит, что способность к регенерации у стволовых клеток пуповинной крови выше, чем клеток, полученных из других источников. Гемопоэтические прогениторы пуповинной крови обладают свойствами, необходимыми для трансплантации. Процесс получения пуповинной крови лёгкий, безболезненный и не противоречит этическим нормам. Клиническое применение пуповинной крови человека [3,16] стало альтернативой использованию костного мозга и мобилизированной периферической крови в качестве источника гемопоэтических стволовых/прогениторных клеток для трансплантации, которые проводятся при злокачественных заболеваниях, анемиях, гемоглобинопатии и врожденных нарушениях метаболизма [3,15].
|
|
|
|
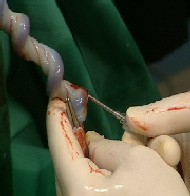
Рис. 1. Забор образца пуповинной крови |
Рис. 2. Деление стволовой мезенхимальной клетки |
Самым серьёзным недостатком пуповинной крови как источника для трансплантации является её небольшой объем. При необходимости повторной трансплантации стволовых клеток применение пуповинной крови предыдущего донора не представляется возможным [3]. Следовательно, существует необходимость тщательного подхода к заготовке и хранению как можно большего объема пуповинной крови с максимальным выходом мононуклеарных клеток.
Для выделения стволовых клеток пуповинной крови новорожденных предложены различные методы и подходы, однако общепринятые отраслевые стандарты до сих пор отсутствуют [21]. В определенной степени решением этой проблемы занимаются создаваемые во всем мире сети банков стволовых клеток - сообщества учреждений, занимающихся заготовкой, хранением и использованием гемопоэтических стволовых клеток пуповинной крови (LIFEBANK Canada, Cord Blood Europe, Netcord). В европейских странах сети банков стволовых клеток поставили цель заготавливать пуповинную кровь максимального числа рождающихся детей как для персонифицированного, так и для донорского хранения. Банки внутри общей сети связаны между собой и имеют возможность обмениваться информацией и образцами стволовых клеток.
В Российской Федерации имеются банки стволовых клеток пуповинной крови, однако федеральная сеть банков до сих пор не создана. При этом, ситуация с донорским материалом для трансплантации больным, в первую очередь, с онкогематологической патологией, продолжает критически ухудшаться. Следовательно, в ближайшее время стоит ожидать дальнейшего развития и реформирования организации работы банков стволовых клеток в РФ.
Банк стволовых клеток Казанского государственного медицинского университета работает на основании лицензии Федеральной службы 2005 года и является подразделением ГОУ ВПО «Казанского государственного медицинского университета» Министерства здравоохранения и социального развития РФ. Банк полностью укомплектован необходимым оборудованием для забора, выделения и хранения стволовых клеток из пуповинной крови. Он является вторым в России по качеству оборудования и оснащенности учреждением подобного типа.
Цель работы - на основании анализа данных, полученных при работе Банка стволовых клеток Казанского государственного медицинского университета, в совокупности с данными мировых и отечественных исследований, разработать прогностические критерии качества заготовки стволовых клеток пуповинной крови.
Задачи:
1. Составление базы данных Банка стволовых клеток за II квартал 2008г. и 2009г. с указанием возможных прогностических критериев, оказывающих влияние на качество заготовки стволовых клеток пуповинной крови.
2. Выделение критериев, по данным мировой и отечественной литературы, оказывающих влияние на чистый вес образца пуповинной крови и концентрацию лейкоцитов в конечном образце стволовых клеток.
3. Разделение женщин на группы для последующей статистической обработки.
4. Статистическая обработка и анализ полученных данных.
5. Соотнесение результатов с имеющимися в литературе данными.
6. Разработка прогностических критериев качества заготовки стволовых клеток пуповинной крови.
Материалы и методы
Обработаны данные по заготовкам пуповинной крови банком стволовых клеток КазГМУ за второй семестр 2008 года и текущий 2009 год (103 заготовки). С помощью программы Statistica 8 было проанализировано влияние различных факторов на чистый вес пуповинной крови и содержание лейкоцитов в 1 мкл пуповинной крови. Образцы пуповинной крови были разделены на группы по:
1) возрасту женщины:
- группа нормородящих женщин (21-30 лет) - 51 чел.;
- группа возрастных женщин (31-41 год) - 49 чел.
2) числу родов:
- группа первородящих женщин (47 чел.);
- 2-е роды (43 чел.);
- 3 и более роды (14 чел.).
3) способу родоразрешения:
- группа женщин с родоразрешением через естественные родовые пути (62 чел.);
- группа женщин с оперативным родоразрешением (39 чел.).
4) интервалу времени от забора крови до выделения лейкоцитарной фракции:
- менее 3 часов - 29 чел.;
- от 3 до 6 часов - 31 чел.;
- от 6 до 12 часов - 19 чел.;
- от 12 до 24 часов - 23 чел.
Результаты
Исследовано 103 образца пуповинной крови, чистый вес образцов в среднем составил 71,3±27,2г., концентрация лейкоцитов 25959±11324,5 в мкл.
Зависимость от порядка родов
У первородящих чистый вес образца составил в среднем 65,46±30,24 г., что статистически достоверно выше, чем при вторых родах (в среднем 76,85±23,52 г., p<0,05). Однако мы не выявили статистической зависимости между порядком родов у женщины и концентрацией лейкоцитов (диаграмма 1).
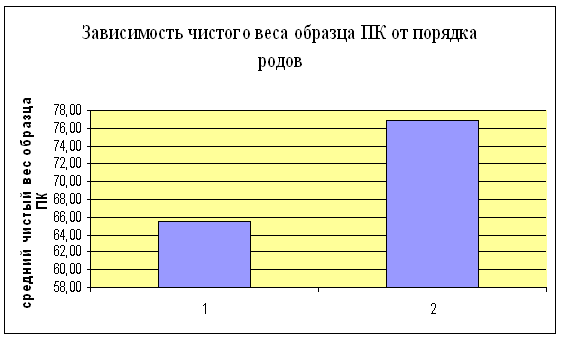
Диаграмма 1. 1 - первородящие; 2 - повторнородящие
Зависимость от возраста женщины
При оценке объема пуповинной крови у нормородящих и возрастных рожениц было установлено, что в первой группе результаты лучше (75,2±30,06г.), чем во второй (67,9±24,04г.) (p<0,05). Статистической зависимости между возрастом женщины и концентрацией лейкоцитов не выявлено (диаграмма 2).
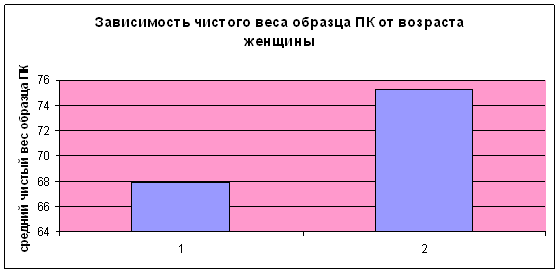
Диаграмма 2. 1 - нормородящие; 2 - возрастные
Зависимость от способа родоразрешения
При родоразрешении путём операции кесарева сечения (2) чистый вес образца пуповинной крови статистически достоверно выше (80,6±31,26г.), чем при естественном (1) родоразрешении (65,93±23,3г.) (p<0,05). Статистической зависимости между способом родоразрешения и концентрацией лейкоцитов не выявлено (диаграмма 3).
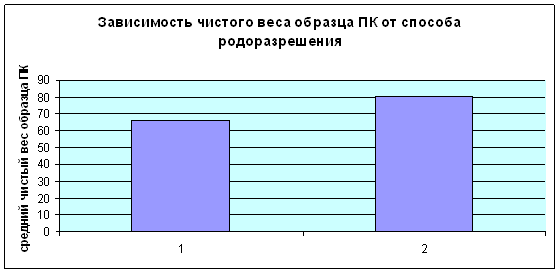
Диаграмма 3. 1 - при родах
через естественные родовые пути;
2 - при оперативном родоразрешении
Зависимость от времени выделения мононуклеарной фракции
При выделении стволовых клеток в промежутке между 12 и 24 ч. концентрация мононуклеарных клеток была достоверно выше (p<0,05), чем при выделении во временном интервале с 3 до 6 часов (28025±12112,89/мкл по сравнению с 22959,5±10012,89/мкл) (диаграмма 4).
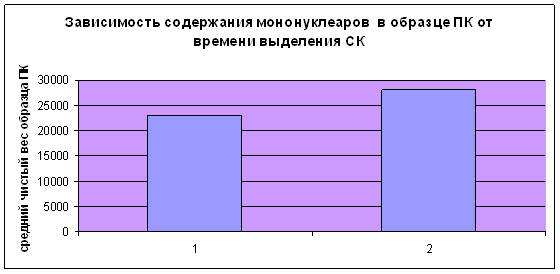
Диаграмма 4. 1 - при выделении в интервале 3-6 ч. после получения образца; 2 - при выделении в интервале 12-24 ч. после получения образца
Обсуждение
При заготовке стволовых клеток пуповинной крови основными показателями, отражающими качество образца и прогнозирующими эффективность его применения для трансплантации являются чистый вес образца и концентрация мононуклеарных клеток. На данные показатели влияет ряд факторов:
1. Вес плода. Ряд работ указывает на то, что высокий вес при рождении коррелирует с объемом образца пуповинной крови и концентрацией в нем мононуклеарных клеток [20,21]. По другим данным, корреляция между весом плода и объемом образца крови, а также концентрацией стволовых клеток в образце отсутствует [13].
По данным W. C. Strohsnitter, T. M. Savarese, разные популяции стволовых клеток пуповнной крови по-разному коррелируют с весом плода:
CD34+CD38--клетки: концентрация повышается в среднем на 15,5% на каждые 500г. веса плода;
CD34+ и CD34+c-kit+-клетки: зависимость концентрации от веса плода имеет J-образный вид;
CFU-GM - клетки: зависимость концентрации от веса плода имеет U-образный вид с максимальной концентрацией при весе 3000г.
По данным Ballen KK, Wilson M дети, имеющие больший вес при рождении, в пуповинной крови имеют большую концентрацию CD34+ и CFU-GM - клеток. Прибавка веса на 500г. даёт увеличение концентрации CD34+ на 28%(7). Однако в исследованиях российских авторов не показано зависимости объёма собранной крови от веса плода [3].
1. Способ родоразрешения. Ряд исследований указывает на увеличение чистого веса и концентрации стволовых клеток в случае кесарева сечения, в то время как другие свидетельствуют об отсутствии какой-либо зависимости [3,21]. Кесарево сечение, выполненное в неотложном порядке, по данным Armson M.A., ассоциировано с низким весом образца пуповинной крови [3]. По нашим данным чистый вес образца пуповинной крови, полученного после кесарева сечения, в среднем, выше, чем вес крови, полученной после естественного родоразрешения, что соотносится с данными литературы.
2. Способ получения крови. При получении крови до рождения плаценты (in utero) чистый вес и концентрация стволовых клеток выше, риск контаминации ниже [3,21,27]. Методика получения пуповинной крови с промыванием одной из пуповинных артерий 0,9% р-ром NaCl позволяет получить больший объём образца [3,13,27].
По данным Wong A, Yuen PM, в пуповинной крови, взятой после рождения плаценты (ex utero) средняя концентрация ядросодержащих клеток и КОЕ была достоверно ниже (на 9,5% 11,6% соответственно), сгустков наблюдалось больше. Снижение количества стволовых клеток достоверно коррелировало со снижением общего числа клеток в пуповинной крови. Возможно, гибель клеток обусловлена началом свёртывания крови в отделившейся плаценте [27].
По данным C. Pafumi, M. Farina, в случае кесарева сечения чистый вес крови и концентрация стволовых клеток также выше при заборе крови до отделения плаценты [23]. Профессор К.М. Абдулкадыров отмечает, что во время операции при ручном отделении плаценты от слизистой оболочки матки нередко происходит массивное механическое повреждение маточной поверхности последа, что приводит к высвобождению и попаданию в пуповинную кровь большого количества тканевого тромбопластина, который запускает механизм внутрисосудистого свертывания крови. В таких случаях пуповинная кровь может свернуться еще до начала эксфузии крови. ([1]: из 42 заготовок крови из уже выделенной плаценты (после кесарева сечения) в 5 случаях не удалось получить кровь объемом более 10 мл вследствие того, что она свернулась внутри сосудов).
По данным Armson M.A. объём крови, полученный ex utero, увеличивается при одноплодной беременности, кесаревом сечении, стимуляции родовой деятельности, длине пуповины более 30 см, весе плода 3500г и весе плаценты более 700 г [3].
3. Число родов в анамнезе: концентрация стволовых клеток выше в случае первых родов [20,21]. По данным Ballen KK, Wilson M, каждые последующие роды снижают концентрацию CD34+ в пуповинной крови на 17% [7]. По нашим данным, объём пуповинной крови, получаемый при вторых родах, достоверно выше. Число стволовых клеток в образце, однако, соотносится с таковым у первородящих. Таким образом, можно полагать, что увеличение объёма пуповинной крови при вторых родах носит компенсаторный характер.
4. Срок гестации: Максимальная концентрация стволовых клеток в пуповинной крови наблюдается с 34 по 37-ю неделю гестации [9]. По данным Broxmeyer HE, Hangoc G, концентрация стволовых клеток пуповинной крови обратно пропорциональна срок гестации [12]. Каждая неделя гестации приводит к снижению концентрации CD34+ клеток в пуповинной крови на 9%[7]. По данным Ballen KK, Wilson M, переношенные дети имеют большее содержание клеток в пуповинной крови, но концентрация CD34+ и CFU-GM в крови таких детей снижена. Однако по данным Armson M.A. объём пуповинной крови при преждевременных родах будет меньше, чем при срочных [3]. По другим данным, корреляции нет [13].
5. Продолжительность родов: Чем длительнее протекают роды, тем больший объём пуповинной крови удаётся получить [12, 20,21]. Даже при заборе крови ex utero (по результатам исследования, менее благоприятном) и продолжительности родов более 15 часов объём крови значительно возрастает [3].
6. Время от рождения ребёнка до пережатия пуповины: объём образца пуповинной крови тем больше, чем раньше пережата пуповина [20]. Быстрейшее пережатие пуповины с последующим прикладыванием новорожденного к животу роженицы увеличивает концентрацию стволовых клеток в пуповинной крови. [3,12]. По данным Bertolini F, Lazzari L концентрация стволовых клеток в пуповиной крови наивысшая, если пуповина была пережата в первые 30 секунд после рождения ребёнка. По данным профессора К.М.Абдулкадырова, если от рождения ребёнка до момента пережатия пуповины проходило менее 14 секунд, то средний чистый вес образца крови составлял 80 мл, от 15 секунд - 70 мл и менее.
Но, в то же время, Hutton E.K., Hassan E.S. указывают, что более позднее пережатие пуповины (через 2 мин. после рождения ребёнка и позже) благоприятнее для новорожденного, снижает риск анемии на 47%, риск дефицита железа на 33% в возрасте от 2 до 3 месяцев. [20]
7. Время от получения образца крови до выделения мононуклеарной фракции, температура хранения образца до разделения также влияет на количественный выход мононуклеарных клеток, эритроидных предшественников и колониеобразующих единиц гранулоцитов и моноцитов [2]. Наименьшие потери клеточного материала при длительности хранения до 72 часов отмечены при температуре +25°С, а наибольшие - при +4°С. [3]. Наши исследования также показали, что при выделении мононуклеарной фракции через 12-24 часа после забора образца эффективность лейкоконцентрации повышается. Это согласовывается с данными Е.Э. Карповой и, вероятно, связано с естественной гибелью клеток в результате процессов апоптоза. Относительная эффективность лейкоконцентрации оказывается выше, тогда как абсолютное количество выделенных клеток меньше, чем при обработке до 20 часов. Временной интервал от 10 до 20 часов оптимален, так как некроз и апоптоз достигают своего естественного максимума, и в это время еще не происходит гибель гемопоэтических СК и мала вероятность контаминации образца пуповинной крови [2].
8. Раса: концентрация стволовых клеток в пуповинной крови по одним данным, выше у представителей афро-американской расы [21], по другим данным, у европеоидов [20]. Ряд исследователей не выявляет зависимости между расой, чистым весом и концентрацией стволовых клеток пуповинной крови [7].
9. Вредные привычки матери: курение снижает концентрацию стволовых клеток в пуповинной крови. Возможно, влияние курения обусловлено негативным влиянием на вес плода [21].
10. Вес плаценты: существует прямая зависимость между весом плаценты и количеством полученной крови [13, 21].
11. Длина пуповины: объём образца пуповинной крови положительно коррелирует с длиной пуповины новорожденного [20].
12. Пол плода: по данным Aroviita P. концентрация ядросодержащих клеток в пуповинной крови девочек выше, в основном, за счёт большего содержания нейтрофилов. В то же время, содержание гематопоэтических стволовых клеток выше в пуповинной крови мальчиков [5].
Заключение
В результате исследования было установлено:
чистый вес образца ПК выше:- у повторнородящих по сравнению с первородящими;
- у возрастных рожениц по сравнению с нормородящими;
- при оперативном родоразрешении по сравнению с родоразрешением через естественные родовые пути;
при выделении стволовых клеток в промежутке с 12 до 24 часов после получения пуповинной крови концентрация мононуклеаров достоверно выше, чем при выделении клеток в промежуток с 3 до 6 часов с момента получения образца пуповинной крови.Таким образом, по материалам нашего исследования, к прогностическим факторам при выделении стволовых клеток пуповинной крови можно отнести:
v число родов в анамнезе;
v способ родоразрешения;
v время обработки образца.
Предлагается особое внимание уделять качеству заготовки образцов пуповинной крови у нормородящих, роды которых протекают через естественные родовые пути.
СПИСОК ЛИТЕРАТУРЫ
1. Абдулкадыров К.М., Романенко Н.А., Селиванов Е.А. Наш опыт по заготовке, тестированию и хранению гемопоэтических клеток пуповинной крови. Клеточная трансплантология и тканевая инженерия № 1(3), 2006.:63-65. 2. Карпова Е.Э. Прогнозирование эффективности обработки пуповинной крови с трансплантационными целями. Автореферат диссертации на соискание учёной степени кандидата медицинских наук. Г.Москва, 2008г. 3. Федорова Т.А., Аппалуп М.В. Использование пуповинной крови как альтернатива донорским трансфузиям в неонатологии. Клеточная трансплантология и тканевая инженерия № 1(3), 2006.: 39-41. 4. Armson B.A. Umbilical Cord Blood Banking: Implications for Perinatal Care Providers. SOGC clinical practice guidelines №156, March 2005. 5. Aroviita P. Haematopoietic Stem Cell Units for Transplantation. Academic dissertation. Helsinki, 2005 6. Aroviita P, Teramo K, Hiilesmaa V, Kekomaki R. Cord blood hematopoietic progenitor cell concentration and infant sex. Transfusion. 2005;45:613-621.7. Ballen KK, Wilson M, Wuu J, Ceredona AM, Hsieh C, Stewart FM, Popovsky MA, Quesenberry PJ. Bigger is better: maternal and neonatal predictors of hematopoietic potential of umbilical cord blood units.Bone Marrow Transplant. 2001 Jan;27(1):7-14.
8. Bárcena A., Muench M.O., Kapidzic M., Susan J., Fisher S.J. A new role for the human placenta as a hematopoietic site throughout gestation. Reprod Sci. 2009 February; 16(2): 178-187.9. Bertolini F, Lazzari L, Lauri E, Corsini C, Castelli C, Gorini F, Sirchia G. Comparative study of different procedures for the collection and banking of umbilical cord blood. J Hematother. 1995 Feb;4(1):29-36.
10. Bhattacharya A, Slatter MA, Chapman CE, Barge D, Jackson A, Flood TJ, Abinun M, Cant AJ, Gennery AR. Single centre experience of umbilical cord stem cell transplantation for primary immunodeficiency. Bone Marrow Transplant. 2005;36:295-299.11. Broxmeyer HE, Douglas GW, Hangoc G, Cooper S, Bard J, English D, Arny M, Thomas L, Boyse EA. Human umbilical cord blood as a potential source of transplantable hematopoietic stem/progenitor cells. Proc Natl Acad Sci U S A. 1989;86:3828-3832.
12. Broxmeyer HE, Hangoc G, Cooper S, Ribeiro RC, Graves V, Yoder M, Wagner J, Vadhan-Raj S, Benninger L, Rubinstein P. Growth characteristics and expansion of human umbilical cord blood and estimation of its potential for transplantation in adults. Proc Natl Acad Sci U S A. 1992;89:4109-4113.
13. Donaldson C., Armitage W. John, Laundy V., Barron C., Buchanan R., Webster J., Bradley B., Hows J. Impact of obstetric factors on cord blood donation for transplantation. British Journal of Haematology. Vol.106 Is.1:128 - 132.
14. U. Elchalal, S. Fasouliotis, D. Shtockheim, C. Brautbar, J. Schenker, D. Weinstein, A. Nagler. Postpartum umbilical cord blood collection for transplantation: A comparison of three methods. American Journal of Obstetrics and Gynecology, Vol. 182, Is.1: 227-232.
15. Gluckman E. Current status of umbilical cord blood hematopoietic stem cell transplantation. Exp Hematol. 2000; 28: 1197-205.
16. Gluckman E., Broxmeyer H.E., Auerbach A.D. et al. Hematopoietic reconstitution in a patient with Fanconi´s anemia by means of umbilical cord blood from an HLA-identical sibling. N Engl J Med. 1989; 321: 1174-82
17. E. G. Gluckman, Vanderson Rocha, Claude Chastang. Use of Cord Blood Cells for Banking and Transplant. The Oncologist, Vol. 2, Oct.1997.No. 5:340-343.
18. Grewal SS, Barker JN, Davies SM, Wagner JE. Unrelated donor hematopoietic cell transplantation: marrow or umbilical cord blood? Blood. 2003;101:4233-4244.
19. Hao QL, Shah AJ, Thiemann FT, Smogorzewska EM, Crooks GM. A functional comparison of CD34 + CD38- cells in cord blood and bone marrow. Blood. 1995;86:3745-3753.
20. Hutton E.K., Hassan E.S. Late vs Early Clamping of the Umbilical Cord in Full-term Neonates. Systematic Review and Meta-analysis of Controlled Trials JAMA. 2007; 297(11):1241-1252. 21. Jones J, Stevens CE, Rubinstein P, Robertazzi RR, Kerr A, Cabbad MF. Obstetric predictors of placental/umbilical cord blood volume for transplantation. Am J Obstet Gynecol. 2003 Feb;188(2):503-9. 22. Moise, Kenneth. J. Umbilical Cord Stem Cells Obstetrics & Gynecology. Dec 2005, Vol.106, Is 6:1393-1407.23. C. Pafumi, M. Farina, S. Bandiera, A. Cavallaro, G. Pernicone, A. Russo, A. Iemmola, M. Chiarenza, I. Leonardi, A.E. Calogero, A. Calcagno, A. Cianci Differences in Umbilical Cord Blood Units Collected during Cesarean Section, before or after the Delivery of the Placenta. Gynecologic and Obstetric Investigation. Vol.54, №2, 2002.
24. Peters C, Steward CG. Hematopoietic cell transplantation for inherited metabolic diseases: an overview of outcomes and practice guidelines. Bone Marrow Transplant. 2003;31:229-239.
25. Solvesa P, Lópezb M., Mirabeta M., Blanquera A.. Roiga R, Peralesb A. Characteristics of Umbilical Cord Blood Units Collected from Preterm Deliveries. Gynecologic and Obstetric Investigation. Vol. 68, No. 3, 2009.
26. Strohsnitter W. C., Savarese T. M., Low H. P., Chelmow D. P., Lagiou P., Lambe M., Edmiston K., Liu Q., Baik I., Noller K. L., Adami H-O, Trichopoulos ., Hsieh C-C. Correlation of umbilical cord blood haematopoietic stem and progenitor cell levels with birth weight: implications for a prenatal influence on cancer risk. Br J Cancer. 2008 February 12; 98(3): 660-663.
27. Surbek DV, Scho Ёnfeld B, Tichelli A, Gratwohl A, Holzgreve W. Optimizing cord blood mononuclear cell yield: a randomized comparison of collection before vs after placenta delivery. Bone Marrow Transplantation, (1998) 22, 311-312.28. Wong A, Yuen PM, Li K, Yu AL, Tsoi WC. Cord blood collection before and after placental delivery: levels of nucleated cells, haematopoietic progenitor cells, leukocyte subpopulations and macroscopic clots. Bone Marrow Transplant. 2001 Jan;27(2):133-8.
ИНТЕРНЕТ-РЕСУРСЫ
i. www.lifebank.com
ii. http://cordbloodeurope.org
iii. http://www.celltranspl.ru
iv. http://www.nap.edu
v. http://www.cryo-save.com
vi. http://www.pupowina.ru - сайт банка стволовых клеток Казанского ГМУ.
vii. http://www.ncbi.nlm.nih.gov/pmc/
ПРИЛОЖЕНИЕ
Типы стволовых клеток пуповинной крови
В пуповинной крови к настоящему времени охарактеризовано несколько типов прогениторных клеток: (1) стволовая кроветворная клетка, (2) стволовая мезенхимная клетка, (3) прогениторная эндотелиальная клетка, (4) SP (side population) клетка, способная дифференцироваться в миогенном и кроветворном направлениях, а также (5) клетки, экспрессирующие специфические CD маркёры, дающие начало разным клеточным типам.
Методы получения концентрата клеток пуповинной крови
Заготовку пуповинной крови производили после получения информированного согласия у беременной женщины, которая проходила тщательный дородовый скрининг на наличие противопоказаний к донорству пуповинных клеток (тяжелые соматические заболевания, отягощенный семейный анамнез, акушерская патология). Донором не могла быть беременная женщина при положительных результатах тестирования на наличие следующих инфекций: ВИЧ 1 и 2, сифилис, гепатиты В и С, острую стадию инфекций, вызванных вирусом простого герпеса 1 и 2, цитомегаловирусом, токсоплазмой (в соответствии с Приказом Минздрава РФ от 14.09.2001 №364 об утверждении порядка медицинского обследования доноров крови и ее компонентов).
Пуповинная кровь забиралась специально обученным персоналом роддома по инструкции Банка стволовых клеток Казанского медицинского университета. Сразу после рождения ребенка и отсечения пуповины кровь собирали в стандартную систему для взятия донорской крови (контейнеры пластиковые одинарные CPDA-1 250 GG, Terumo). Забор пуповинной крови осуществляли как в ходе родов через естественные родовые пути, так и в случае оперативного родоразрешения путем кесарева сечения. Отработанная техника забора позволяла медицинскому персоналу контролировать количество получаемой пуповинной крови. Риск бактериального загрязнения был минимален.
Рис. 3. Контейнер пластиковый одинарный CPDA-1 250 GG, Terumo
Информация, указываемая в акушерском анамнезе:
1) возраст женщины;
2) дата и время забора крови;
3) срок беременности;
4) какие по счёту роды;
5) сколько плодов;
6) нормальные или оперативные роды;
7) число проколов пуповины для получения крови;
8) общий вес контейнера с кровью.
Пуповинную кровь в изотермическом контейнере в течение 12-24 часов после забора доставляли в Банк стволовых клеток, где из нее выделяли концентрат клеток пуповинной крови. Столь жесткие временные рамки обусловлены тем, что фракционирование пуповинной крови при помощи центрифугирования наиболее эффективно при использовании свежих образцов.
Выделение концентрата клеток с максимальным выходом мононуклеаров автоматическим методом
Метод заключается в выделении концентрата ядросодержащих клеток с помощью сепаратора клеток "Sepax" фирмы Biosafe (в соответствии с инструкциями производителя). В образец пуповинной крови добавляли 6%-ый гидроксиэтилкрахмал в объёме 20% от объёма пуповиной крови с антикоагулянтом (1,2% - конечная концентрация гидроксиэтилкрахмала). В течение 10 минут проводили смешивание на миксере. Далее контейнер присоединяли к набору для сепарации клеток крови "Sepax" (CS-530) и, используя протокол USB-HES 180, подвергали процессингу. В результате получали 20 мл концентрата ядросодержащих клеток для дальнейшего исследования.
Рис. 4. Сепаратор клеток "Sepax"
Подсчет количества и определение жизнеспособности ядросодержащих клеток
К 10 мкл полученного образца добавляли 520 мкл 0,9%-раствора натрия хлорида и 260 мкл 0,4%-раствора трипанового синего. Для ручного метода с использованием фиколла к 10 мкл полученного образца добавляли 10 мкл 0,4%-раствора трипанового синего. После тщательного перемешивания аликвоты объёмом 20 мкл помещали в предварительно подготовленную камеру Горяева. Подсчет проводили в 40 больших квадратах, концентрацию ядросодержащих клеток выводили по формуле (А*250*В/С, где А - число подсчитанных ядросодержащих клеток, В - разведение, С - число подсчитанных квадратов).
При подсчете ядросодержащих клеток мы разделяли их на 2 популяции - окрашенные (нежизнеспособные) и неокрашенные (жизнеспособные). Процент жизнеспособности рассчитывали как отношение числа жизнеспособных (неокрашенных) клеток к общему количеству ядросодержащих клеток. Во всех полученных образцах количество жизнеспособных клеток не было менее 97%.