Введение
Хронические облитерирующие заболевания артерий нижних конечностей (ХОЗАНК) - группа тяжелых хронических заболеваний сосудов нижних конечностей, ведущих к ишемии тканей, развитию перемежающейся хромоты и, в тяжелых случаях, к гангрене конечности. Рост заболеваемости и снижение среднего возраста больных, а также низкая эффективность традиционного консервативного и хирургического лечения диктуют необходимость поиска принципиально новых методов лечения данных заболеваний, одним из которых может стать клеточная терапия с использованием стволовых клеток (СК). Многочисленные доклинические исследования показали достоверное увеличение плотности капиллярной сети и развитие коллатералей в мышечной ткани при введении СК, полученных из различных источников (мезенхимальных СК (6,11), СК периферической (5,10), пуповинной крови (8, 12), костного мозга (1,4,7,15), эмбриональных СК (2)), на различных моделях ишемии нижних конечностей (4,13). В то же время ограниченные клинические исследования по изучению влияния трансплантации СК больным ХОЗАНК носили характер пилотных (14), либо оценивали терапевтический эффект на основе данных инструментальных и физикальных методов обследования (увеличение среднего расстояния до наступления болей; уменьшение болевого синдрома в покое; заживление трофических язв; потепление кожных покровов; увеличение чрескожного давления кислорода; усиление кровотока по результатам УЗ-доплерографии, образование новых коллатералей при ангиографическом исследовании) (3,9). Таким образом, до сих пор ни в одном исследовании не были достоверно освещены изменения в мышечной ткани на микроструктурном уровне и не выяснены морфологические основы наблюдаемых после введения СК клинических улучшений. Также ни одно из ранее опубликованных исследований не было проведено на достаточном числе пациентов с ХОЗАНК, позволяющее провести статистически достоверный анализ данных об эффективности клеточной терапии. Целью нашей работы стало изучение влияния трансплантированных СК на плотность капиллярной сети мышечной ткани у больных ХОЗАНК.
Для изучения морфологических основ терапевтического эффекта лечения ХОЗАНК СК нами был проведен клинический эксперимент по трансплантации аутологичных СК периферической крови 30-и больным ХОЗАНК (27 больных с диагнозом облитерирующий атеросклероз дистальных артерий нижних конечностей и 3 больных с диагнозом облитерирующий тромбангиит) с забором биопсии мышцы пораженной конечности до и после введения СК.
Методы
Пациенты. Клиническая часть эксперимента была выполнена на базе отделения сосудистой хирургии Республиканской клинической больницы Министерства Здравоохранения Республики Татарстан (РКБ МЗ РТ). Для проведения процедуры забора и введения СК были выбраны 30 пациентов (мужчины в возрасте 40-60 лет) с диагнозом облитерирующий тромбангиит, облитерирующий атеросклероз дистальных артерий нижних конечностей, установленными на основе результатов УЗ-доплерографии, ангиографии и реографии.
У всех пациентов было получено информированное согласие на эксперимент. Протокол эксперимента одобрен Республиканским Комитетом по Этическим Вопросам.
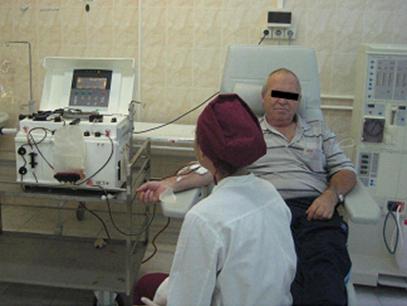
Рис. 1. Процедура проведения лейкафереза
Подготовка аутологичных СК. В течении пяти дней пациентам производили подкожные инъекции рекомбинантного препарата гранулоцитарного колониестимулирующего фактора G-CSF (нейпоген), после чего проводили процедуру лейкафереза (рис.1), в результате чего получали конечный продукт - лейкоцитарную массу, обогащенную клетками-предшественниками гемопоэза. Часть объема полученного продукта использовали для подсчета общего числа лейкоцитов и CD34+ клеток (CD34 - наиболее известный и надежный маркер гемопоэтических СК) клеток методом проточной цитометрии на базе Банка СК КГМУ.
Имплантация СК и забор биопсии. Операцию по забору биопсии (рис.2) производили под комбинированным наркозом: нейролептаналгезия (фентанил+дроперидол) и инфильтрационная анестезия (лидокаина 0,25% р-р).
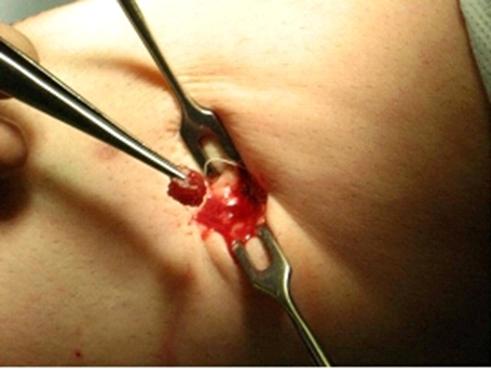
Рис. 2. Процедура забора биопсии
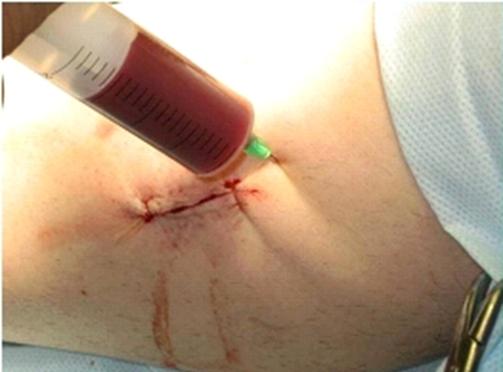
Рис. 3. Процедура введения лейкоцитарной фракции
Разрез кожи и фасций производили на уровне середины голени, выделяли медиальную часть икроножной мышцы, производили забор мышцы размерами 0,5х0,5х0,5см. После обеспечения гемостаза и послойного ушивания раны производили введение клеточной суспензии (рис. 3) в заднюю и переднюю группу мышц голени по описанной схеме (14). Забор повторной биопсии производили с соблюдением вышеизложенной техники через 12 недель после введения клеточной суспензии.

Рис. 4. Иммуногистохимическое окрашивание
Иммуногистохимия. После фиксации в 10% нейтральном растворе формалина биоптаты заливали по стандартной методике в парафин, полученные парафиновые срезы (5-7 μm) для визуализации капилляров подвергали иммуногистохимическому окрашиванию (рис.4) с коммерческими моноклональными антителами к CD31 (клон 1А10, Novocastra, UK, разведение 1:10), CD34 (клон QBEnd/10, Novocastra, UK, разведение 1:75), vWF (клон F8/86, DAKO, Denmark, разведение 1:25) с помощью системы визуализации Novocastra Novolink. Ядра клеток докрашивали гематоксилином.
Подсчет плотности капилляров. После визуализации капилляров на полученных образцах на двух срезах биопсий выбирали по 3 случайных поля зрения. Подсчитывали число капилляров в каждом поле. Чтобы исключить влияние возможных интерстициального отека и мышечной гипертрофии или атрофии на плотность капиллярной сети, определяли количество капилляров на одно мышечное волокно.
Статистическая обработка данных. Обработку данных производили с помощью статистического графического пакета Microsoft Excel. Определяли коэффициент корреляции Пирсона, достоверность проверяли с помощью t-критерия Стьюдента (р<0,05).
Результаты
По результатам иммуногистохимического окрашивания на предварительном этапе работы нами был выбран маркер эндотелия, наиболее подходящий для визуализации капилляров на парафиновых срезах мышечной ткани. По данным окрашивания срезов биопсий (рис.5) на эндотелиальные маркеры (CD31, CD34, vWF) было установлено, что экспрессия CD31 и vWF представлена в эндотелии крупных сосудов и отдельных капилляров и в целом очень вариабельна и непостоянна. Окрашивание с антителами к CD34 было стабильным и позволяло выявить как все капилляры, так и крупные сосуды. На основании вышеизложенного анализ данных о плотности капиллярной сети производился по результатам окрашивания с антителами к CD34.
По результатам произведенного окрашивания на CD34 (рис. 6) было выявлено, что среднее соотношение «капилляры/мышечное волокно» (1,23±0,17, p<0,05) значительно возрастает после аутотрансплантации СК периферической крови (1,85±0,24, р<0,05). Среднее увеличение плотности капиллярной сети (рис. 7) составило 33, 25% (p<0,05).
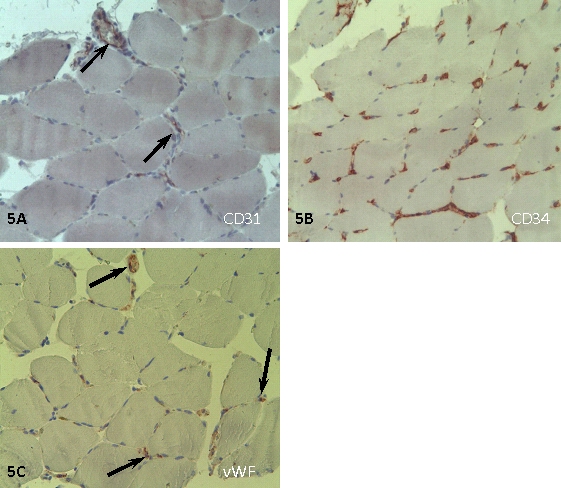
Рис. 5. Иммуногистохимическое окрашивание биопсии больного М. на эндотелиальные маркеры (CD31, CD34, vWF), увеличение х200. СD31-позитивное окрашивание (А) выявляется в крупных сосудах (указаны стрелками), vWF (С) - в крупных сосудах и единичных капиллярах, CD34 (В) - в сосудах и капиллярах. Эндотелий капилляров и сосудов - красное окрашивание, ядра - синее.
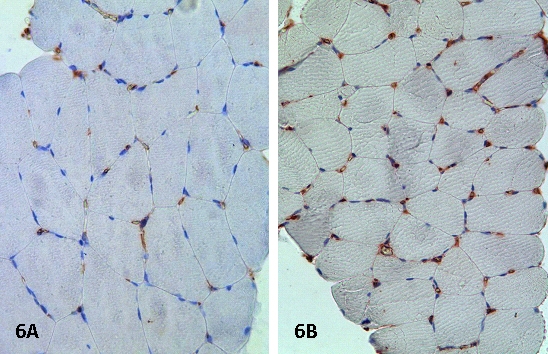
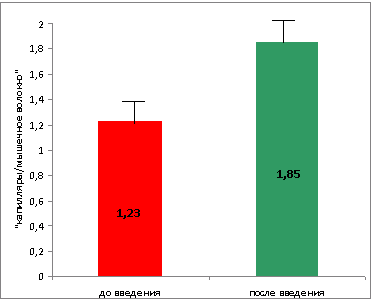
Рис. 7. Среднее соотношение «капилляры/мышечное волокно» до и после аутотрансплантации СК периферической крови. Среднее соотношение «капилляры/мышечное волокно» (1,23±0,17, p<0,05) значительно возрастает после аутотрансплантации СК периферической крови (1,85±0,24, р<0,05).
Заключение
Аутотрансплантация СК периферической крови приводит к улучшению васкуляризации ишемизированной конечности путем стимуляции развития микроциркуляторного русла. Указанные изменения происходят, по-видимому, за счет дифференцировки трансплантированных СК в эндотелиоциты. Также нельзя исключить возможность продукции введенными СК ангиогенных факторов (кислый и щелочной фактор роста фибробластов aFGF и bFGF, эндотелиальный фактор роста сосудов VEGF, ангиопоэтин-1), стимулирующих рост капилляров.
Таким образом, в нашем исследовании впервые отражены морфологические основы клинических улучшений у больных ХОЗАНК, отмеченных предыдущими работами. Аутологичная трансплантация СК периферической крови является новым эффективным методом достижения терапевтического ангиогенеза, способным значительно повысить качество жизни больных ХОЗАНК.
В дальнейшем нами планируется изучение терапевтического эффекта в зависимости от количества введенных СК, от количественного состава и фенотипа введенных клеток, а также изучения путей дифференцировки введенных клеток, в том числе по миогенному и ангиогенному пути.
СПИСОК ЛИТЕРАТУРЫ
1. Al-Khaldi A, Al-Sabti H, Galipeau J, Lachapelle K. Therapeutic angiogenesis using autologous bone marrow stromal cells: improved blood flow in a chronic limb ischemia model. Ann Thorac Surg 2003;75:204-209
2. Cho S-W, Moon S-H, Lee S-H, Kang S-W, Kim J, Lim JM, Kim H-S, Kim B-S, Chung H-M. Improvement of Postnatal Neovascularization by Human Embryonic Stem Cell-Derived Endothelial-Like Cell Transplantation in a Mouse Model of Hindlimb Ischemia. Circulation 2007;116;2409-2419.
3. Higashi Y, Kimura M, Hara K, Noma K, Jitsuiki D, Nakagawa K, Oshima T, Chayama K, Sueda T, Goto C, Matsubara H, Murohara T, Yoshizumi M. Autologous Bone-Marrow Mononuclear Cell Implantation Improves Endothelium-Dependent Vasodilation in Patients With Limb Ischemia. Circulation 2004;109;1215-1218
4. Hirata K, Li TS, Nishida M, Ito H, Matsuzaki M, Kasaoka S, Hamano K. Autologous bone marrow cell implantation as therapeutic angiogenesis for ischemic hindlimb in diabetic rat model. Am J Physiol Heart Circ Physiol. 2003;284:H66 -H70.
5. Iba O, Matsubara H, Nozawa Y, Fujiyama S, Amano K, Mori Y, Kojima, H, Iwasaka T. Angiogenesis by implantation of peripheral blood mononuclear cells and platelets into ischemic limbs. Circulation. 2002;106: 2019 -2025
6. Ishikane S, Ohnishi S, Yamhara K et al. Allogeneic Injection of Fetal Membrane-Derived Mesenchymal Stem Cells Induces Therapeutic Angiogenesis in a Rat Model of Hind Limb Ischemia. STEM CELLS 2008;26:2625-2633
7. Iwase T, Nagaya N, Fujii T, Itoh T, Ishibashi-Ueda H, Yamagishi M, Miyatake K, Matsumoto T, Kitamura S, Kangawa K. Adrenomedullin Enhances Angiogenic Potency of Bone Marrow Transplantation in a Rat Model of Hindlimb Ischemia. Circulation 2005;111;356-362
8. Kim SW, Han H, Chae GT et al. Successful stem cell therapy using umbilical cord blood-derived multipotent stem cells for Buerger´s disease and ischemic limb disease animal model. STEM CELLS 2006;24:1620 -1626
9. Kudo FA, Nishibe T, NIishibe M, Yashuda K. Autologous transplantation of peripheral blood endothelial progenitor cells (CD34+) for therapeutic angiogenesis in patients with critical limb ischemia. Inter Ang Dec.2003, Vol.22, No.4
10. Madeddu P, Emanueli C, Pelosi E, Salis MB, Cerio AM, Bonanno G,Patti M, Stassi G, Condorelli G, Peschle C. Transplantation of low dose CD34+/KDR+ cells promotes vascular and muscular regeneration in ischemic limbs. FASEB J. 2004;18:1737-1739.
11. Moon MH, Kim SY, Kim YJ, Kim SJ, Lee JB, Bae YC, Sung SM, Jung JS. Human adipose tissue-derived mesenchymal stem cells improve postnatal neovascularization in a mouse model of hindlimb ischemia. Cell Physiol Biochem. 2006;17:279-290.
12. Pesce M, Orlandi A, Iachininoto MG, Straino S, Torella AR, Rizzuti V,Pompilio G, Bonanno G, Scambia G, Capogrossi MC. Myoendothelial differentiation of human umbilical cord blood-derived stem cells in ischemic limb tissues. Circ Res. 2003;93:e51- e62.
13. Rochester JR, Brown NJ, Reed MW. Characterisation of an experimental model of chronic lower limb ischaemia in the anaesthetised rat. Int J Microcirc Clin Exp 1994;14:27-33.
14. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda U, Shintani S, Masaki H, Amano K, Kishimoto Y, Yoshimoto K, Akashi H, Shimada K, Iwasaka T, Imaizumi T. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 2002;360: 427- 435.
15. Yoshida M, Horimoto H, Mieno S, Nomura Y, Okawa H, Nakahara K, Sasaki S. Intra-Arterial Bone Marrow Cell Transplantation Induces Angiogenesis in Rat Hindlimb Ischemia. Eur Sur g Res 2003;35:86-91.



