Введение
Одним из компонентов реакции организма на акупунктуру является её иммуностимулирующее действие. Реализуется данный эффект через изменение активности селезенки, тимуса и костного мозга [4]. В последнее время усилился интерес практических врачей к акупунктуре, как к методу, улучшающему работу иммунной системы и увеличивающему резервные возможности организма [14, 21]. Так, иглоукалывание в точки ST 36, LI 4, LI 11, достоверно увеличивает уровень Ig G, Ig M, Ig A, IL 4, IL 6, IL 10, C 3, C 4, INF gamma, а также численность CD 4+, CD 8+ клеток в сыворотке крови [18, 20]. Особый интерес представляют ранние этапы иммуногенеза, поскольку, вероятно, в это время складываются условия, во многом определяющие весь ход иммунологических реакций. Нейромедиаторы и нейропептиды, высвобождающиеся из нервных окончаний, могут модулировать секрецию гормонов и функциональную активность клеток [5, 12]. Однако, анализ данных литературы показывает отсутствие исследований нейромедиаторного обеспечения селезенки после акупунктурного воздействия [3, 4, 7, 16].
Цель: исследование взаимосвязей между моноаминсодержащими структурами селезенки в ответ на однократную процедуру иглоукалывания на разных временных сроках эксперимента.
Материал и методы исследования
Была исследована селезенка 45 белых беспородных крыс-самцов массой 180-200 г. после иглоукалывания в симметричные точки акупунктуры LI 4 и GV 14 (рис. 1).
Выбор точки определялся следующими параметрами: точка акупунктуры GV 14 (принадлежит XIV заднесрединному меридиану - Governing Vessei) является дорсальной точкой общего действия и расположена между остистыми отростками VII шейного и I грудного позвонка, LI 4 (принадлежит II меридиану толстой кишки - Large Intenstine) - является дистальной точкой, обладающей иммуномодулирующей активностью и высокой клинической эффективностью. Она расположена на передней конечности между I и II пястной костью [4]. Локализацию точек акупунктуры проводили при помощи анатомо-топографического метода и при помощи прибора «Элитерис». Электрокожное сопротивление в точке акупунктуры составляло 55-65 кОм, вне точки - более 100 кОм.
Животные были разделены на 3 группы: 1-я - интактная - без воздействия (№=5); 2-я - контрольная - иглоукалывание проводили сбоку от меридиана, рядом с каждой исследованной точкой на расстоянии 5 мм (№=20); 3-я - опытная - иглоукалывание проводили стальными иглами в течение 10 мин в точки акупунктуры GV 14 и LI 4 (№=20). Селезенки извлекали под эфирным наркозом через 15 мин, 1, 2 и 4 ч после иглоукалывания. Данные, полученные при изучении селезенки опытных крыс, сравнивали с соответствующими значениями у контрольных животных. По данным литературы известно, что весной морфология селезенки отличается наиболее полной выявляемостью гранулярных люминесцирующих клеток (ГЛК) и адренергических нервных волокон [5, 15]. Учитывая эти факты, мы попытались исключить влияние сезонности, поэтому все эксперименты по каждому сроку проводились в один день в одно и то же время суток в весенний период.
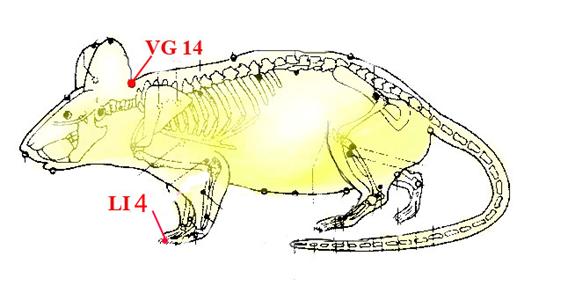
Рис. 1. Локализация акупунктурных точек у крысы
Для люминесцентного метода приготавливались криостатные срезы толщиной 15 мкм. Для световой микроскопии кусочки селезенки фиксировались в забуференном растворе формалина и заливались в парафин по стандартной методике. Исследовались срезы толщиной 5 мкм.
1. Люминесцентно-гистохимический метод Фалька [17] в модификации Е.М. Крохиной применяли для выявления катехоламин- и серотонинсодержащих структур селезенки.
2.
Для
более полной оценки изменений биоаминного обеспечения селезенки при
иглоукалывании для всех исследуемых структур селезенки вычисляли серотониновый
индекс (Is). Метод определения Is: Is = ∑![]() ,
,![]() где [С] -концентрация серотонина в одной
клетке, [КА] - концентрация катехоламинов в одной клетке, N - число клеток. По
серотониновому индексу можно судить о преобладании серотонина в клетке (Is>1), либо катехоламинов (Is<1). Эти данные могут быть полезны
при оценке состояния иммунной системы, так как серотонин обладает способностью
увеличивать количество лимфоцитов-супрессоров и подавлять иммунный ответ [10].
где [С] -концентрация серотонина в одной
клетке, [КА] - концентрация катехоламинов в одной клетке, N - число клеток. По
серотониновому индексу можно судить о преобладании серотонина в клетке (Is>1), либо катехоламинов (Is<1). Эти данные могут быть полезны
при оценке состояния иммунной системы, так как серотонин обладает способностью
увеличивать количество лимфоцитов-супрессоров и подавлять иммунный ответ [10].
3. Окраска гематоксилин-эозином применялась для оценки характера воздействия иглоукалывания на селезенку.
4. Окраска полихромным толуидиновым синим по А. Унна использовалась для контроля состояния тканевых мукополисахаридов и гепарина.
5. Компьютерная морфометрия цифровых видеоизображений применялась для измерения размеров лимфоидных фолликулов селезенки и проводилась с помощью программы Adobe PhotoShop 10.
6. Подсчитывалось число мегакариоцитов, эозинофилов, миелоцитов, митозов визуально в 10 полях зрения.
В работе приводятся следующие показатели: M - средняя арифметическая величина; m - средняя ошибка средней арифметической величины. Статистическую достоверность определяли критерием Стьюдента (t). Корреляционный анализ применялся для выявления достоверной взаимосвязи между показателями интенсивности люминесценции катехоламинов и серотонина в изучаемых структурах селезенки. Математическая обработка с вычислением коэффициента корреляции и его достоверности проводилась на компьютере по специально разработанной программе [1].
Обзор литературы
Селезенку относят к периферическим иммунокомпетентным органам, в ней происходит заключительный этап антигензависимой дифференцировки Т-популяции лимфоцитов и превращение образовавшихся здесь В-лимфоцитов в плазмоциты. Селезенка отвечает за антигенный гомеостаз крови, продуцирует ряд гуморальных факторов, среди которых Ig (в том числе хорошо опсонизирующие антитела), цитокины (тафтсин, спленин) и другие [5].
Селезенка получает адренергическую, ацетилхолинергическую, пептидергическую иннервацию. Адренергический компонент вегетативной нервной системы представлен в селезенке очень широко [8]. Кровеносные сосуды имеют насыщенные периваскулярные и адвентициальные адренергические сплетения, образованные волокнами, имеющими периодические овоидные расширения. После обработки парами формальдегида (по Фальку) волокна имеют зелено-изумрудную люминесценцию [15]. Часть тончайших волокон проникает в лимфоидные узелки и сближается с составляющими их клетками. Холинергические нервные структуры в большей мере связаны с сосудами и субкапсулярной частью паренхимы селезенки. От этих образований отдельные нервные волокна направляются к лимфоидным узелкам, проникают к ним и ветвятся. При использовании макромикроскопического метода препарирования установлено, что основным источником иннервации селезенки является селезеночное сплетение. Изучение архитектоники селезеночного сплетения и его взаимоотношения с селезеночной артерией в разных частях сосуда и в паренхиме органа показало, что нервы окружают селезеночную артерию со всех сторон [2].
ГЛК селезенки относят к типу дендритных клеток, которые, как и другие клетки макрофагальной природы (звездчатые эндотелиоциты печени, альвеолярные макрофаги легких, клетки Лангерганса эпидермиса кожи и др.), обладают антигенпрезентирующими свойствами. Рядом авторов дендритные клетки рассматриваются как идеальные клетки, регулирующие активность Т-лимфоцитов и представляющие им антиген. Дендритные клетки также способны запускать продукцию цитокинов, необходимых как для индукции покоящихся В-клеток, так и для концевой дифференцировки В-лимфоцитов в плазматические клетки (в отличие от макрофагов, не способных к такой стимуляции). Презентативные свойства дендритных клеток обусловлены наличием на мембранах клеток Ia-антигена, относящегося к антигенам главного комплекса гистосовместимости II класса [5].
В настоящее время считается, что дендритные клетки являются макрофагами мезенхимальной природы, которые мигрируют из красного костного мозга в эпидермис кожи, где меняют свою форму на отростчатую, теряют способность к фагоцитозу, приобретая там характерные для дендритных клеток гранулы Бирбека и свойства антигенпрезентирующих клеток.
После обработки срезов селезенки иммуногистохимическими методами с использованием антисывороток к серотонину, мелатонину, СТГ, нейронспецифической энолазе, синаптофизину на территории органа выявляются клетки - апудоциты. ГЛК селезенки не только способны поглощать, продуцировать и секретировать биогенные амины, но и осуществляют другие реакции, характеризующие клетку APUD-системы (аргирофилия, скрытая метахромазия, положительная реакция с альдегид-фуксином) [13].
Собственные исследования
После обработки методом Фалька в селезенке интактных животных хорошо различимы белая и красная пульпа, a. centralis определяется в виде диффузного зеленоватого ободка. Вокруг периартериальной (Т-зависимой) зоны можно видеть небольшое число ГЛК до 5-7 в одном поле зрения. Согласно данным электронной микроскопии и Любовцевой Л.А., часть ГЛК относится к макрофагам, а часть из них принадлежит клеткам APUD-серии [8, 12].
На темном фоне герминативного центра лимфоидного узелка выявляются ГЛК, имеющие вид крупных, полигональных структур. В одном центре размножения лимфоидного узелка (В-зависимая зона) определяются до 7 ГЛК с уровнем катехоламинов равным 11,3±1,03 у.е. и С - 15,3±1,08 у.е. Во всех лимфоидных узелках определяются адренергические нервные волокна, входящие в узелок по адвентиции кровеносных сосудов и образующие сплетение вокруг a. centralis. и отходящих от нее артериол. Около краевой зоны на границе с маргинальным синусом определяется цепочка люминесцирующих клеток в количестве 13-17, состоящая из ГЛК и тучных клеток. Немногочисленные ГЛК красной пульпы обладают размерами 15-16 мкм и имеют насыщенно-желтый цвет.
Иглоукалывание в течение 10 мин в точки акупунктуры VG 14 и LI 4 приводило к различным реакциям со стороны биоаминсодержащих структур селезенки.
Через 15 мин после иглоукалывания вокруг лимфоидного узелка появляется темный нелюминесцирующий ободок, отделяющий его от красной пульпы. Содержание катехоламинов и серотонина резко возрастает в ГЛК реактивного центра в 5,4 и 5,5 раза соответственно (табл. 1). В лимфоцитах реактивного центра содержание моноаминов достоверно повышается в 2,6 и 2,5 раза соответственно. В периартериальной зоне концентрация исследованных трансмиттеров увеличивается в 6,5 раз и достигает своего максимума для всех сроков эксперимента (рис. 3). В селезенке контрольных крыс подобные изменения носили характер тенденции.
Через 1 ч после иглоукалывания содержание катехоламинов и серотонина в ГЛК реактивного центра увеличивается более чем в 2 раза, в лимфоцитах этой зоны - в 1,4 раза по сравнению с предыдущим сроком и достигает максимальных цифр. Появляется цепочка ГЛК в маргинальной зоне: уплотненный ободок из этих клеток встречается по периферии большинства (60 %) лимфоидных узелков. В периартериальной зоне и в красной пульпе уровень моноаминов постепенно начинает снижаться, однако превышает первоначальные показатели, более чем в 3 раза. В ГЛК красной пульпы содержание катехоламинов и серотонина вернулось к первоначальным показателям. Контуры адренергических терминалей просматриваются не всегда четко и кажутся размытыми. Контрольные срезы отличаются невысокой интенсивностью свечения моноаминов в фоне красной пульпы.
По истечении 2 ч после иглоукалывания периферическое кольцо из ГЛК маргинальной зоны разрыхляется. В большинстве лимфоидных узелков определяются одиночные желтые гранулы с высокой концентрацией моноаминов, что свидетельствует о дегрануляции ГЛК. В реактивном центре на этом сроке обнаруживается небольшое число ГЛК - 3,5±0,28 в одном поле зрения. Содержание катехоламинов и серотонина в них упало в 4,2 и в 4,4 раза соответственно. В периартериальной зоне содержание исследуемых веществ продолжает снижаться. Выявляемость адренергических нервных волокон по сравнению с предыдущим сроком увеличивается. В контрольных срезах изменений со стороны ГЛК не обнаруживалось, адренергические волокна выглядели тонкими, с уменьшенным числом варикозных расширении.
К 4 ч после воздействия в большинстве лимфоидных узелков ГЛК около маргинальной зоны вновь образуют цепочку. Среди ГЛК около реактивного центра появляются крупные (25-26 мкм) яркие угловато-округлые клетки с компактно-упакованными желтоватыми гранулами с низким содержанием катехоламинов и серотонина.
Концентрация моноаминов в ГЛК как реактивного центра и красной пульпы за последние 2 ч не претерпевала достоверных изменений.
Тенденция к снижению показателей люминесценции заметна в периартериальной зоне, в фоне красной пульпы и лимфоцитах реактивного центра, причем динамика изменений в центральной артерии и периартериальной зоне идентична. Адренергические нервные волокна определяются полнее, чем у контрольных животных. В контроле отмечаются признаки дегрануляции ГЛК маргинальной зоны. Выраженных изменений показателей люминесценции катехоламинов и серотонина в структурах лимфоидных узелков контрольных животных на 1 и 4 часовом сроках не отмечается.
Все структуры селезенки интактной группы крыс имели небольшие значения Is от 1,28 до 1,55, различающиеся в зависимости от исследуемой структуры. Достоверные изменения Is зарегистрированы нами к концу 1 ч после иглоукалывания. В ГЛК реактивного центра, ГЛК красной пульпы Is имеет тенденцию к увеличению, тогда как в периартериальной зоне и лимфоцитах реактивного центра наблюдается противоположная тенденция. Через 2 ч фон реактивного центра и периартериальная зона лимфоидного узелка отреагировали снижением Is.
Для оценки взаимообусловленности процессов, происходящих в селезенке при иглоукалывании, были проанализированы корреляционные связи между наиболее активными участниками иммунного ответа. Так, у интактных животных были установлены, в основном, умеренные корреляционные связи в исследованных парах (табл. 2). После иглоукалывания происходит ослабление связей между ГЛК реактивного центра и ГЛК красной пульпы как по катехоламинам, так и по серотонину, по-видимому, это связано с усилением поглощения этих моноаминов. В парах ГЛК реактивного центра и a. centralis, ГЛК красной пульпы и a. centralis наблюдается усиление корреляционных связей, т.к. усиливается выход биоаминов из крови. В паре между ГЛК и лимфоцитами реактивного центра происходит усиление связей, возможно, вследствие того, что ГЛК отдают моноамины в реактивный центр лимфоцитам: идет их активное созревание. В паре ГЛК реактивного центра и периартериальная зона происходит усиление корреляционных связей, из-за того, что ГЛК отдают исследуемые вещества в периартериальную зону.
Таблица 1
Интенсивность люминесценции серотонина и катехоламинов (M±m) и серотониновый индекс (Is) в структурах селезенки крыс после 10-минутного иглоукалывания в точки акупунктуры GV 14 и LI 4 в разные сроки (M±m)
|
|
Интактная группа крыс (n=5) |
Через 15 мин после ИУ (n=5) |
Через 1 ч после ИУ (n=5) |
Через 2 ч после ИУ (n=5) |
Через 4 ч после ИУ (n=5) |
|||||||||||
|
С |
КА |
Is |
С |
КА |
Is |
С |
КА |
Is |
С |
КА |
Is |
С |
КА |
Is |
||
|
Фон реактивного центра |
17,75 ±1,31 |
11,5 ±1,5 |
1,54 |
41,3 ±3,64* |
29,0 ±1,54 |
1,44 |
56,7 ±5,26* |
38,0 ±3,64 |
1,45 |
24,75 ±0,63* |
18,0 ±0,41* |
1,38 |
14,83 ±0,91 |
9,67 ±0,76 |
1,53 |
|
|
Фон красной пульпы |
8,3 ±0,7 |
6,2 ±0,5 |
1,33 |
34,16 ±3,36* |
23,83 ±2,38 |
1,43 |
26,88 ±2,73* |
20,3 ±1,67 |
1,34 |
14,33 ±0,88* |
9,5 ±0,73* |
1,51 |
8,5 ±0,5 |
5,7 ±0,48 |
1,48 |
|
|
ГЛК |
реактивного центра |
15,3 ±1,08 |
11,3 ±1,03 |
1,35 |
84,6 ±7,33 |
60,8 ±4,52 |
1,39 |
182,5 ±51,24** |
131,7 ±27,27* |
1,49 |
41,71 ±0,49 |
30,86 ±4,76* |
1,35 |
34,2 ±3,15* |
23,4 ±2,46* |
1,46 |
|
красной пульпы |
19,5 ±0,65 |
15,25 ±0,48 |
1,28 |
48,0 ±1,08 |
34,0 ±1,64 |
1,41 |
25,6 ±1,83** |
16,0 ±0,71 |
1,6 |
25,14 ±2,24*** |
19,1 ±1,08** |
1,31 |
25,25 ±2,32*** |
18,4 ±1,36*** |
1,42 |
|
|
Периартерильная зона |
8,5 ±0,5 |
5,5 ±0,5 |
1,55 |
54,0 ±6,51* |
36,0 ±4,0 |
1,5 |
45,0 ±2,025 |
32,0 ±1,6 |
1,41 |
23,5 ±1,5 |
18,0 ±1,0 |
1,31 |
12,5 ±0,5 |
9,0 ±0,75* |
1,39 |
|
Примечание. С - серотонин, КА - катехоламины, ИУ - иглоукалывание; ГЛК - гранулярные люминесцирующие клетки. * p<0,001; ** p<0,02, *** p<0,05 по сравнению с показателями в интактной группе.
Таблица 2
Корреляционные взаимоотношения по катехоламинам и серотонину между люминесцирующими структурами селезенки после иглоукалывания
|
Исследованные пары |
Контроль |
КА/КА |
Контроль |
С/С |
|
ГЛК реактивного центра / ГЛК красной пульпы |
0,53 |
0,04 |
0,47 |
0,22 |
|
ГЛК реактивного центра / Адренергические нервные волокна стенки a. centralis |
0,47 |
0,78 |
0,48 |
0,75 |
|
ГЛК реактивного центра / Фон реактивного центра |
0,35 |
0,94* |
0,37 |
0,95* |
|
ГЛК реактивного центра / Периартериальная зона |
0,5 |
0,96** |
0,51 |
0,96** |
|
ГЛК реактивного центра / ГЛК периартериальной зоны |
0,12 |
0,14 |
0,14 |
0,18 |
|
ГЛК периартериальной зоны / Фон реактивного центра |
0,33 |
0,43 |
0,31 |
0,49 |
|
ГЛК красной пульпы / Периартерильная зона |
0,33 |
0,63 |
0,35 |
0,79 |
Примечание. КА - катехоламины, С - серотонин; ГЛК - гранулярные люминесцирующие клетки.
* p<0,01; ** p<0,001
При обзорной окраске селезенки крыс гемотоксилин-эозином в фолликулах различимы центральная артерия, расположенная или на периферии, или внутри белой пульпы, окружена лимфоцитами периартериальной лимфоидной муфты, центр размножения, мантийная зона, маргинальная зона. Красная пульпа составляет около 80 % общей массы органа.
Через 15 мин после иглоукалывания лимфоидные узелки имеют разные размеры, отростчатую форму. Центры размножения сдвинуты на периферию белой пульпы. В трабекулах увеличивается васкуляризация. Морфологическая картина контрольных животных не отличается от наблюдаемой в норме.
Через 1 ч после воздействия морфологическая картина по сравнению с предыдущим сроком не изменилась.
По истечении 2 ч после воздействия размеры лимфоидных фолликулов увеличиваются (табл. 3). В красной пульпе выявляются скопления лимфоцитов. В срезах контрольных животных отмечается системное расширение венозных сосудов красной пульпы.
Через 4 ч после иглоукалывания лимфоидные узелки имеют неправильную форму, разные размеры и часть из них сливаются между собой. Выраженный реактивный центр не определяется. Около сосудов образуются 2-3 скопления лимфоцитов. В красной пульпе усиливается созревание мегакариоцитов, исчезают незрелые (базофильные) мегакариоциты. Вокруг краевого синуса имеется мантия из клеток лимфоидного ряда. В срезах контрольных животных наблюдается гиперплазия лимфоидного узелка.
Методом Унна в селезенке интактных животных красная и белая пульпа визуально отличимы друг от друга. Они окрашены ортохромно, но не равномерно. Лимфоидные узелки имеют небольшие размеры и более насыщенный голубой цвет по сравнению с красной пульпой. Центральные артерии определяются, имеют неокрашенную стенку. Реактивный центр выявляется только в лимфоидных узелках большого диаметра. Самую слабую окраску имеет маргинальная зона лимфоидного узелка. Кровеносные сосуды красной пульпы не окрашены. В небольшом числе выявляются мегакариоциты с ортохромным многолопастным ядром и неокрашенной цитоплазмой.
Через 15 мин после воздействия реакция с толуидиновым синим показала наличие темно-синего ободка вокруг ядра лимфоцитов периартериальной лимфоидной зоны, часть лимфоцитов маргинальной зоны становятся метахроматичными. В капсуле обнаруживаются дегенеративные ß2-метахроматичные тучные клетки. Морфологическая картина селезенки контрольных животных сходна с таковой у интактных.
По истечению 2 часов после иглоукалывания определяются лимфоидные узелки с четким краем, с эксцентричным расположением реактивного центра. В красной пульпе наблюдается разрастание соединительной ткани. Среди клеток красной пульпы встречаются мегакариоциты (2-3 в поле зрения), гиперхромноокрашенные лимфоциты (до 4 в поле зрения). В срезах контрольных животных лимфоидные узелки окружены светлоокрашенным маргинальным синусом. Кровеносные сосуды красной пульпы не окрашены.
Через 4 часа после воздействия в лимфоидных узелках наблюдается увеличение количества клеток: среди которых - лимфоциты, миелоциты, набухшие клетки ретикулоэндотелия. Белая пульпа представлена узкоплазменными плазмоцитами и мегакариоцитами. В срезах контрольных животных обнаруживается увеличение размера лимфоидного узелка, с выраженным реактивным центром.
Таблица 3
Морфометрические показатели лимфоидного фолликула селезенки после иглоукалывания в разные сроки в мкм (M±m)
|
|
Интактная группа |
15 мин после ИУ |
2 ч после ИУ |
4 ч после ИУ |
|
№=5 |
№=5 |
№=5 |
№=5 |
|
|
Диаметр поперечного среза лимфоидного фолликула |
363,3±37,52 |
442,1±16,16* |
451,4±30,93* |
405,8±23,67 |
|
Диаметр продольного среза лимфоидного фолликула |
311,7±21,36 |
304,4±24,54 |
334,3±21,94 |
386,9±36,42* |
Примечание: ИУ - иглоукалывание. * p<0,05 по сравнению с показателями в интактной группе.
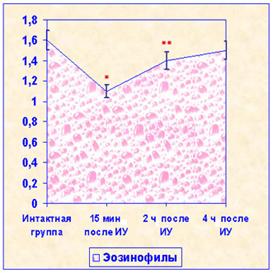
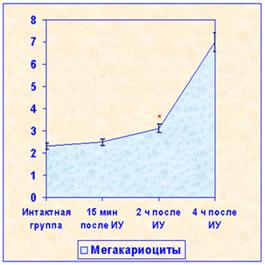
Иглоукалывание приводит к изменению цитологических показателей красной пульпы селезенки (рис. 2). Отмечается снижение числа эозинофилов через 15 мин после иглоукалывания, с последующим возвращением к норме. Число мегакариоцитов начинает возрастать к 2 ч после воздействия, а через 4 ч увеличивается более чем в 2,5 раза.
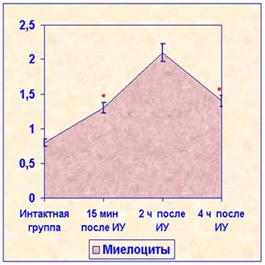
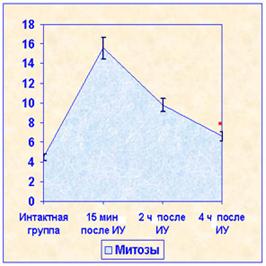
Наибольшее увеличение числа миелоцитов замечено через 2 ч после иглоукалывания, а числа митозов, как в красной, так и белой пульпе через 15 мин после процедуры.
|
|
|
|
|
|
|
|
|
Рис. 2. Динамика цитологических показателей селезенки крыс после иглоукалывания в разные сроки Примечание: * p<0,001;** p<0,05 по сравнению с показателями в интактной группе |
|
|
Обсуждение полученных данных
Полученные данные являются свидетельством того, что иглоукалывание в точки акупунктуры LI 4 и GV 14 изменяет морфо-функциональное состояние селезенки крыс: вызывает перестройку биоаминного обеспечения селезенки, изменение содержания моноаминов в структурах селезёнки, причём как в Т-зависимых, так и в В-зависимых зонах, а также перераспределение клеточных популяций в лимфоидных узелках селезенки крыс.
После воздействия иглоукалыванием увеличивается выявляемость адренергических нервных волокон, что говорит об активации периферического звена вегетативной нервной системы. Адренергическая иннервация обильна в красной пульпе селезенки, где выявляются многочисленные ГЛК, тесно контактирующие с нервными терминалями. Эти данные могут указывать на наличие функциональной связи между названными структурами. Наши исследования дополняют данные о том, что обеспечение биоаминами осуществляется не только нервными волокнами, но и клетками, содержащими биоамины - ГЛК. По данным литературы ГЛК реактивного центра проявляют свойства местных моноаминопродуцентов. ГЛК красной пульпы обладают, напротив, аминопоглотительными свойствами [5, 8, 12, 15]. ГЛК красной пульпы селезенки в основном представлены макрофагами: в частности интердигитирующими клетками и дендритными клетками.
Через 15 мин после иглоукалывания отвечают лимфоциты красной пульпы и периартериальной зоны повышением уровня исследуемых трансмиттеров. ГЛК реактивного центра отвечают на иглоукалывание значительным повышением концентрации биоаминов к концу 1 ч. ГЛК красной пульпы реагируют кратковременным повышением уровня моноаминов через 15 мин после процедуры, к концу 1 ч концентрация исследуемых трансмиттеров в них снижается до первоначальных показателей. Это объясняется тем, что катехоламины угнетают фагоцитарную активность макрофагов [3, 15]. Возможно, основная часть излишков моноаминов утилизируется не через поглощение макрофагами красной пульпы, а с помощью моноаминооксидазной системы.
По прошествии 4 ч биоаминный статус структур селезенки восстанавливается до исходных цифр. Сопоставив полученные данные с показателями Is, мы обнаружили, что иглоукалывание вызывает относительное повышение содержания серотонина в большей степени в периартериальной зоне и в реактивном центре. Действие его после иглоукалывания усиливается через 1 ч. Известно, что серотонин в низких концентрациях активирует супрессорную активность, увеличивая выработку IgM и IgG В-лимфоцитами, изменяя миграцию супрессоров в костный мозг, а также контролируя скорость пролиферации иммунокомпетентных клеток. [19, 20, 21].
Реакция с толуидиновым синим показала наличие темно-синего ободка вокруг ядра лимфоцитов периартериальной лимфоидной зоны, а также часть лимфоцитов маргинальной зоны становятся метахроматичными через 15 мин после воздействия, что может говорить об ускорении созревания лимфоцитов. Невыявляемость тучноклеточной популяции в селезенке, вероятно, объясняется преимущественно обменом биоаминов в ГЛК, а не в тучных клетках. Увеличение В-лимфоцитов, расширение В-зависимых зон селезенки свидетельствует об адаптационном характере изменений [9]. Увеличение размеров лимфоидных узелков при изменении размеров красной пульпы аналогично изменениям в селезенки при применении иммунностимуляторов [11].
Выводы:
1. Полученные данные показывают наличие иммуностимулирующего компонента акупунктуры, проявляющегося в первый час и сохраняющегося до 4 часов после однократного иглоукалывания в точки акупунктуры GV 14 и LI 4.
2. Наиболее реагирующими структурами в ответ на иглоукалывание являются гранулярные люминесцирующие клетки реактивного центра лимфоидного узелка, маргинальной зоны и гранулярные люминесцирующие клетки красной пульпы, а также адренергические нервные волокна a. centralis.
3. В гранулярных люминесцирующих клетках реактивного центра лимфоидного узелка уровень катехоламинов и серотонина начинает возрастать через 15 мин после иглоукалывания, достигает своего максимального значения к концу 1 ч и возвращается к первоначальным показателям к 4 часовому сроку.
4. Серотониновый индекс после иглоукалывания возрастает через 1 ч в гранулярных люминесцирующих клетках реактивного центра и снижается к 2 ч в гранулярных люминесцирующих клетках красной пульпы, но остается во всех структурах выше 1.
5. В красной пульпе селезенки через 2 ч после иглоукалывания появляются скопления лимфоцитов, что может свидетельствовать об активации размножения лимфоцитов.
СПИСОК ЛИТЕРАТУРЫ
1. Автандилов Г.Г. Компьютерная микротелефотометрия в диагностике гистоцитопатологии. М.:РМАПО, 1996. 256 с.
2. Белик О.В., Чертан Г.Н., Зорина З.А., Бабуч А.П., Ботнарь Т.К. Морфологические особенности селезеночного сплетения. // Морфология. 2008. Том 133 (2). С. 18.
3. Бочкарева А.Г. Влияние КВЧ-излучения на структуры селезенки. Автореф. дис. ...канд. мед. наук. Саранск, 2002 . 24 с.
4. Вогралик В.Г., Вогралик В.М. Основы традиционной восточной рефлексодиагностики и пунктурной адаптационной терапии. М., ГОУ ВУНМЦ МЗ РФ, 2001. 336 с.
5. Голубцова Н.Н. Морфофункциональное исследование биогенных аминов в селезенки и печени белых мышей в условиях токсического воздействия толуолом. Автореф. дис. ...канд. мед. наук. Чебоксары, 2001. 23 с.
6. Гурьянова Е.А., Любовцева Л.А., Кроткова О.С., Иванова О.В. Влияние иглоукалывания на биоамины селезенки крыс. // Морфология. 2008. Том 133 (2). С. 37-38.
7. Гурьянова Е.А. Биоаминный статус структур кожи лица в области точек акупунктур у животных и человека в норме и у крыс в эксперименте. Автореф. дис. ...канд. мед. наук. Чебоксары, 2003. 24 с.
8. Гордон Д.С., Сергеева В.Е., Зеленова И.Г. Нейромедиаторы лимфоидных органов. Ленинград,1982. 81 с.
9. Давронов Р.Д., Давронова Ш.Р. Структурно-функциональные особенности адаптивных изменений органов системы иммунитета при антигеном воздействии. // Морфология.2008. Том 133 (2). С. 38.
10. Девойно Л.В., Ильюченок Р.Ю. Моноаминергические системы в регуляции иммунной реакции. Новосибирск: Наука. Сиб. Отд-ние, 1983. 120 с.
11. Каримов Ф.А., Каримов Ш.Ф. Влияние препарата «Биостим» на фабрициеву сумку и селезенку птиц. // Морфология.2008. Том 133 (2). С. 59.
12. Любовцева Л.А. Люминесцентно-гистохимическое исследование аминосодержащих структур костного мозга, тимуса и крови при действии нейромедиаторов и антигенов. Чебоксары, 1993. 98 c.
13. Московский А.В., Любовцева Л.А. Характеристика структур пульпы зуба, содержащих биогенные амины, в норме и при патологии (люминесцентно-гистохимическое исследование). // Морфология. 2008. Том 133 (4). С. 41-45.
14. Роджерс А., Адлер Д. С больной головы... // Итоги. 16.02.1999. С. 51-54.
15. Сысоева Л.А. Люминесцентно-гистохимическая характеристика ранней реакции моноаминсодержащих структур селезенки на антигенное воздействие. Автореф. дис. ...канд. мед. наук. М., 1987. 23 с.
16. Dong L., Yuan D., Fan L., Su L., Fu Z. Effect of He-Ne laser acupuncture on the spleen in rats // Zhen Ci Yan Jiu 1996; 21 (4). P. 64-67.
17. Falck B., Hillarp N.A., Thieme G., Torp A. // J. Histohem. Cytochem. 1962. Vol. 10. P. 348-354.
18. Jong MS., Hwang SJ., Chen FP. Effects of electro-acupunture on serum cytokine level and peripheral blood lymphocyte subpopulation at immune-related and nonimmune-related points. // Acupunct. Electrother. Res. 2006. Vol. 31(1-2). P. 45-59.
19. Eugen-Olsen J., Afzelius P., Andersn L., Iversen J., Kronborg G., Aebech P., Nielsen J.O., Hofmann B. Serotonin modulates immune function in T cells from HIV-seropositive subjects. Clin immunol immunopatathol. 1997. Vol. 84. P. 115-121.
20. Lai M., Wang SM., Wang Y., Tang CL., Kong LW., Xu XY. Effects of electroscupuncture of "Zusanli" (ST 36), "Hegu" (LI 4) and/or (SP 9) on immunofunction in gastric carcinectomy rats. // Zhen Ci Yan Jiu. 2008. Vol. 33 (4). P. 245-249.
21. Mayer DJ. Аcupuncture: an evidence lased review of the clinical literature. Ann. Rev. Med. 2000; 51. P. 49-63.
22. Stefulj. J., Cicin-Sain. L., Schauenstein. K., Jernej. B. Serotonin and immune response6 effect of the amine on in vitro proliferation of rat lympocytes. Neuroimmunomodulation. 2001; 9. P. 103-108.
23. Thomas J. Connor Methylenedioxythamphetamine (MDMA, "Ectazu"): a stressor on the immune system // Immunology. 2004. Vol. 111(4). P. 357-367.