Введение
Целью нашей работы было изучить эффективность инфузионного режима введения петлевых диуретиков (в частности лазикса) в сравнении с болюсным режимом введения, у больных с острой декомпенсацией ХСН.
Актуальность
Сердечная недостаточность - мультисистемное заболевание, при котором первичное нарушение функции сердца вызывает целый ряд гемодинамических, нервных и гормональных адаптационных реакций, направленных на поддержание кровообращения в соответствии с потребностями организма. Быстро прогрессирует с однозначно плохим прогнозом (М. Девис).
Проблема изучения патогенеза, диагностики и лечения сердечной недостаточности (СН) является одной из наиболее актуальных в современной кардиологии. Это обусловлено, прежде всего, высоким уровнем летальности и инвалидизации больных, особенно при развитии СН высоких функциональных классов (ФК). ОСН чаще всего является следствием декомпенсации ХСН. В общей популяции, по данным различных исследований, распространенность ХСН составляет 1,5-2%. Несмотря на значительные достижения в лечении сердечно- сосудистых заболеваний, распространенность ХСН не только не снижается, но неуклонно возрастает. ХСН ежегодно развивается у 1% лиц старше 60 лет и примерно у 10% лиц старше 75 лет (по данным Фремингемского исследования). Смертность от ХСН сравнима со смертностью от злокачественных новообразований - 26-29% больных с клинически выраженной СН умирают в течение одного года, 60% больных- в течение первых 5 лет после постановки диагноза. Поэтому совершенствование алгоритмов ведения пациентов с ХСН является одной из важных проблем в лечении сердечно- сосудистых заболеваний.
Обзор литературы
Этиология
К развитию ХСН приводят многие заболевания сердечно- сосудистой системы, а также некоторые заболевания других систем органов. Ряд авторов считает, что каждый третий человек страдает ХСН в той или иной степени. Все причины развития ХСН можно разделить на несколько групп:
I. Поражение сердечной мышцы - миокардиальная недостаточность.
Первичная (миокардиты)
Вторичные (ремоделирование после ПИКС, тиреотоксикоза)
II. Перегрузка сердечной мышцы.
Перегрузка давлением (аортальный стеноз, ГБ)
Перегрузка объёмом (аортальная недостаточность)
Комбинированная (сложные пороки сердца)
III. Нарушение диастолического наполнения желудочков.
Компенсированная СН на ранних стадиях развития заболевания протекает при минимальных симптомах, не доставляя пациенту ощутимого неудобства. Однако заболевание прогрессирует, особенно при отсутствии соответствующего лечения. К острой декомпенсации процесса может привести ряд причин:
нарушение больными предписаний врачебных рекомендаций (отказ от приёма лекарственных средств и нарушение режима)
ОКС
гипертонический криз
фибрилляция предсердий
физическое перенапряжение
эмоциональное перенапряжение
беременность
избыточное потребление поваренной соли
высокая влажность и температура окружающей среды
Наиболее частой причиной смерти больных с декомпенсацией ХСН в стационаре является прогрессирование основного заболевания, в то же время на причины не связанные с патологией сердца и сосудов, приходится до 30% летальных исходов
Классификация СН
Ø СН по течению делится на:
I. Хроническую
II. Острую
A. Острая декомпенсация хронической СН
B. Впервые возникшую ОСН (de novo) у больных без известного нарушения функции сердца в анамнезе
Ø По клиническим проявлениям
ХСН: 1) с нарушением кровообращения преимущественно по малому кругу кровообращения;
2) по большому кругу кровообращения
3) по обоим кругам кровообращения.
ОСН: 1.Острая декомпенсированная СН
2.Гипертензивная
3.Отек легких (подтвержденный при рентгенографии грудной клетки)
4.Кардиогенный шок
5.СН с высоким сердечным выбросом
6.Недостаточность ПЖ
Ø В зависимости от фракции выброса левого желудочка (ФВ ЛЖ):
1. Со снижением ФВ ЛЖ (систолическая СН);
2. Без снижения ФВ ЛЖ (диастолическая СН).
В зависимости от тяжести состояния для ХСН и ОСН существует несколько классификаций.
ХСН
a) По Стражесско-Василенко:
1. Стадия- начальная. Скрытая недостаточность кровообращения, проявляющаяся появлением одышки, сердцебиении и утомляемости только при физической нагрузке. В покое эти проявления исчезают. Гемодинамика не нарушена. Трудоспособность несколько снижена.
2. Стадия- выраженная СН.
Период А- нарушения гемодинамики в большом либо в малом круге кровообращения в покое, выраженность их умеренная.
Период Б- тяжёлые гемодинамические нарушения в обоих кругах кровообращения.
3. Стадия- терминальная, дистрофическая. Выраженные нарушения гемодинамики, нарушения обмена веществ с необратимыми изменениями в структуре органов и тканей.
b) По NYHA:
I. Класс. Бессимптомная дисфункция левого желудочка
II. Класс. Лёгкая СН, умеренное ограничение физической нагрузки.
III. Класс. Средней степени тяжести, выраженное ограничение физических нагрузок.
IV. Класс. Тяжёлая СН, неспособность выполнять какие- либо нагрузки без появления дискомфорта. Симптомы СН могут появляться в покое.
Класс СН выставляется на основании результатов теста 6-минутной ходьбы:
I. ФК- за 6 минут больной проходит 550-426м.
II. ФК- больной за 6 мин проходит 425-301м
III. ФК- 151-300м
IV. ФК -150м и менее.
c) По американской классификации:
A. Стадия- высокий риск СН но нет ни структурных ни функциональных нарушений.
B. Стадия- развившаяся патология сердца, но признаков СН нет.
C. Стадия- симптомная.
D. Стадия- выраженная патология, рефрактерная к лечению.
ОСН:
1) Классификация Killip T
Стадия I - нет признаков СН.
Стадия II - СН (влажные хрипы в нижней половине легочных полей, III тон, признаки венозной гипертензии в легких).
Стадия III - тяжелая СН (явный отек легких; влажные хрипы распространяются более, чем на нижнюю половину легочных полей).
Стадия IV - кардиогенный шок (САД 90 мм рт.ст. и ниже с признаками периферической вазоконстрикции: олигурия, цианоз, потливость).
2) Классификация Stevenson.
Класс I - нет признаков периферической гипоперфузии и застоя в легких ("теплые и сухие").
Класс II - нет признаков периферической гипоперфузии с застоем в легких ("теплые и влажные").
Класс III - признаки периферической гипоперфузии без застоя в легких ("холодные и сухие").
Класс IV - признаки периферической гипоперфузии с застоем в легких ("холодные и влажные").
Патогенез
При сердечной недостаточности имеет место систолическая или диастолическая дисфункция.
В основе систолической дисфункции лежит расстройство сократимости желудочков и нарушение способности миофибрилл к укорочению после нагрузки, следствием чего является снижение фракции изгнания, способность к повышению ударного объема в ответ на рост преднагрузки нарушается.
Диастолическая дисфункция связана с варьирующей комбинацией нарушения релаксации миокарда и снижением комплайнса желудочков. Как следствие этого наполнение желудочков нарушается, несмотря на рост давления в левом предсердии, что сопровождается симптомами, характерными для легочного и системного застоя.
При снижении сердечного выброса (СВ) минутный объем кровообращения часто поддерживается за счет повышения ЧСС под влиянием симпатической стимуляции. В ответ на падение СВ развивается активация нейроэндокринной системы. Вазоконстрикция опосредуется ренин- ангиотензиновой и симпатической системами и сопровождается перераспределением кровотока от кожи, спланхнического сектора и скелетной мускулатуры в сторону жизненно важных органов, например, мозга и сердца. Тонус вен повышается, что ведет к усилению венозного возврата. Вазоконстрикция является адекватной реакцией в условиях геморрагического шока и гиповолемии, но на фоне сердечной недостаточности часто оказывает неблагоприятное влияние на работу желудочков. Организм на начальных этапах пытается компенсировать нарушения повышением уровня предсердного натрийуретического пептида и адреномедуллина, способных повышать выведение натрия и вызывать вазодилятацию. Несмотря на это, с течением времени развиваются признаки задержки воды и соли, что связано в большей степени с повышением секреции альдостерона и в меньшей степени с усилением выработки антидиуретического гормона.
Таблица 1
Нейрогуморальные изменения при СН.
|
Изменения, вызывающие повышение периферического сосудистого сопротивления. |
Изменения, вызывающие снижение периферического сосудистого сопротивления. |
|
1. Повышение симпатической активности (адреналин, норадреналин) 2. Повышение уровня вазопрессина. 3. Повышение активности ренина и ангиотензина II. 4. Повышение активности альдостерона. 5. Повышение уровня ФНО. 6. Уменьшение эндотелин- зависимой вазодилатации. 7. Уменьшение активности парасимпатической системы. 8. Нарушение работы барорецепторов. 9. Повышение уровня вазоконстрикторных простагландинов. |
1. Повышение уровней предсердного и мозгового натрийуретических пептидов. 2. Повышение уровня допамина. 3. Повышение активности сосудорасширяющих простагландинов (I2, Е2). 4. Повышение уровня сосудорасширяющих пептидов (брадикинин, калликреин). |
Отрицательные последствия компенсаторных механизмов включают прогрессирующее снижение почечного кровотока, угрожающего нарушениями почечной функции, ведут к легочному и системным отекам, дальнейшему падению податливости желудочков и увеличению работы сердца. При одинаковом конечно- диастолическом давлении желудочек с более низким значением податливости будет генерировать значительно меньший ударный объем. Это подчеркивает катастрофические последствия повышения постнагрузки, терапевтическое значение оптимизации комплайнса и проблемы чрезмерно полагаться на измерение гемодинамических давлений (ЦВД, ДЗЛА) не в пользу контроля над объемами камер и скоростями потоков при декомпенсации СН.
Таблица 2
Компенсаторные механизмы, включающиеся при снижении СВ
|
Механизм |
Быстрая адаптация |
Поздняя дезадаптация |
|
1. Задержка натрия и воды |
Увеличение преднагрузки и сердечного выброса |
Отёки, анасарка, застой в лёгких |
|
2. Вазоконстрикция |
Увеличение постнагрузки |
Снижение сердечного выброса |
|
3. Адренергическая стимуляция |
Увеличение сократимости, сердечного выброса, тахикардия |
Аритмии, апоптоз |
|
4. Транскрипция фактора роста клеток |
Гипертрофия, увеличение сердечного выброса |
Дезадаптивная гипертрофия, апоптоз, нероз клеток. |
Одним из грозных осложнений при застойной сердечной недостаточности является отек легких. Существуют противоотечные факторы безопасности. Наибольший клинический интерес представляет такой противоотечный фактор, как увеличение скорости лимфооттока. Поступающая в интерстиций жидкость удаляется лимфатической системой. Увеличение скорости поступления жидкости в интерстиций компенсируется увеличением скорости лимфооттока. Такое увеличение скорости лимфооттока в легких происходит путем значительного снижения сопротивления лимфатических сосудов и небольшого увеличения тканевого давления. Однако скорость лимфотока не может возрастать безгранично. Если жидкость проникает в интерстиций быстрее, чем она может быть дренирована оттуда, то развивается отек. Существуют и другие пути удаления избытка интерстициальной жидкости, в том числе через плевру и средостение. Значение этих альтернативных путей дренирования избытка жидкости до сих пор изучаются. Приводящие к нарушению функционирования лимфосистемы факторы также приводят к замедлению эвакуации отечной жидкости по упомянутым альтернативным путям оттока. Любой фактор, приводящий к снижению скорости лимфотока, увеличивает вероятность образования отека. Лимфатические сосуды легкого впадают в вены на шее, которые, в свою очередь, впадают в верхнюю полую вену. Центральное венозное давление (ЦВД), таким образом, является той силой, которую приходится преодолевать лимфе на пути ее дренирования в венозную систему. Одно время считалось, что лимфатические сосуды могут развивать давление, достаточное для преодоления любого клинически значимого ЦВД. Однако скорость лимфотока при нормальных условиях напрямую зависит от величины ЦВД. При отеке эта зависимость меняется таким образом, что при любом задаваемом значении ЦВД скорость лимфотока оказывается выше, чем при нормальных условиях Такое увеличение скорости лимфотока в легких осуществляется путем небольшого увеличения тканевого давления и значительного снижения сопротивления в лимфатической системе. Таким образом, увеличение ЦВД может значительно снизить скорость лимфотока, что приводит к уменьшению дренирования избытка интерстициальной жидкости и способствует развитию отека. Увеличение ЦВД может способствовать формированию отека легких, так как при повышенном ЦВД нарушается процесс удаления избытка жидкости по лимфатическим путям. Этот факт имеет большое клиническое значение вследствие того, что многие терапевтические мероприятия у больных в критическом состоянии, например вентиляция с постоянным положительным давлением, инфузионная терапия и применение вазоактивных препаратов, приводят к увеличению ЦВД. Проводимая в рутинном порядке терапия может стать причиной нарастания отека или привести к замедлению процесса его рассасывания.
Клиника
Симптомы при СН обусловлены:
1. Снижением СВ и уменьшением кровотока в тканях.
2. Застоем крови в лёгких и повышением венозного давления.
Таблица 3
Клинические проявления СН
|
Механизм развития. |
Орган. |
Клинические проявления. |
|
Снижение СВ и уменьшение кровотока в тканях. |
1. Кожа 2. Мышцы
3. Почки
4. Печень 5. Мозг
6. Лёгкие |
Похолодание, бледность, цианоз. Слабость, утомляемость, молочнокислый ацидоз. Задержка натрия и воды, повышение азотемии. Некрозы, гиперферментемии (редко) Нарушения сна, дыхание Чейн- Стокса, ступор. Одышка, ортопноэ, отёк лёгких, влажные хрипы, плевральный выпот, гипоксемия |
|
Застой крови в лёгких и повышение венозного давления. |
1. Ярёмные вены 2. Кожа 3. Печень
4. Почки 5. Кишечник |
Набухание, переполнение.
Отёк. Увеличение, напряжение, иногда увеличение селезёнки. Протеинурия Асцит, анорексия, нарушения всасывания. |
Выраженность симптомов при острой декомпенсации ХСН может варьировать от кардиальной астмы до отёка лёгких и кардиогенного шока. У больного внезапно появляется или быстро нарастает ощущение нехватки воздуха, удушья. Больной возбуждён, испуган, принимает положение ортопноэ. ЧДД увеличивается до 30 в мин, появляется тахикардия. Отмечается бледность, потливость. Если интерстициальный отёк лёгкого перешёл в альвеолярный, одышка нарастает, возникает клокочущее дыхание, слышное на расстоянии. Появляется белая или розовая пенистая мокрота. Отёк лёгкого развивается чаще ночью, когда больной находится в горизонтальном положении. Прогрессирующий отёк приводит к смерти. При развитии кардиогенного шока больной становится вялым, заторможенным. Появляются признаки расстройства периферического кровообращения: бледность, цианоз, похолодание кожи. САД снижается до 80 и менее. Очень важным симптомом является снижение диуреза до 20 мл в час, что свидетельствует о развитии острой почечной недостаточности.
Диагностика
Существуют Фремингемские критерии диагностики СН. Для установления этого диагноза необходимо наличие двух больших или одного большого и двух малых критериев:
Таблица 4
Фремингемские критерии СН
|
БОЛЬШИЕ КРИТЕРИИ |
МАЛЫЕ КРИТЕРИИ |
|
1. Приступы одышки по ночам. 2. Ортопноэ 3. Расширение вен шеи 4. Влажные хрипы в лёгких 5. Кардиомегалия 6. Острый отёк лёгких 7. Ритм галопа 8. Повышение венозного давления 9. Гепато-югулярный рефлюкс 10. Увеличение магнезиального времени |
1. Отёки ног 2.Ночной кашель 3. Одышка при нагрузке 4. Гепатомегалия 5. Плевральный выпот 6. Тахикардия 7. Снижение массы тела в ответ на лечение |
Диагностика СН основывается на данных как клинического, так и инструментального исследования.
При декомпенсации ХСН во время общего осмотра обращают на себя внимание вынужденное положение (ортопноэ), бледность кожных покровов, цианоз, массивные отёки (вплоть до анасарки). Характерны тахипноэ, тахикардия. При перкуссии выявляется увеличение границ сердца, плевральный выпот, выпот в брюшную полость (асцит). При аускультации лёгких выслушиваются сухие рассеянные (при приступе кардиальной астмы) или влажные (при отёке лёгких) хрипы. При аускультации сердца может выслушиваться ритм галопа.
ЭКГ в 12 стандартных позволяет определить ритм сердца, иногда прояснить этиологию острой декомпенсации ХСН.
Рентгенография грудной клетки следует проводить как можно раньше у всех больных с ОСН для оценки размеров и чёткости тени сердца, а также выраженности застоя крови в лёгких. Это диагностическое средство используется как для подтверждения диагноза, так и для оценки эффективности лечения. Позволяет отличить левожелудочковую недостаточность от воспалительных заболеваний лёгких. Важно учитывать, что рентгенологические признаки застоя в лёгких не являются точным отражением повышенного давления в легочных капиллярах; они могут отсутствовать при ДЗЛА вплоть до 25 мм. рт. ст. и поздно реагируют на благоприятные изменения гемодинамики, связанные с лечением- возможна задержка до 12ч.
Из лабораторных исследований всем больным необходимо выполнить: ОАК (включая тромбоциты), биохимический анализ сыворотки крови (определение мочевины, креатинина, трансаминаз, калия, натрия, сахара крови), общий анализ мочи, определение сердечных тропонинов I или Т, МВ- фракция КФК. При возможности определить BNP или NT-proBNP. При тяжёлой СН или сахарном диабете определить газы артериальной крови. У пациентов получающих непрямые антикоагулянты и при тяжёлой СН определить МНО. При подозрении на тромбоэмболические осложнения (может быть ложноположительным при высоком уровне СРБ и у больных с длительной госпитализацией) D-димер.
ЭХО КГ необходимо для определения структурных и функциональных изменений, лежащих в основе СН. Её применяют для оценки и мониторирования локальной и общей функции желудочков сердца, структуры и функции клапанов, патологий перикарда, объёмных образований сердца. Важнейшим гемодинамическим параметром является определение ФВ ЛЖ, отражающая сократительную способность миокарда ЛЖ. Определение ФВ ЛЖ позволяет отдифференцировать пациентов с систолической дисфункцией, от тех, у кого систолическая функция сохранена. О сохранности систолической функции свидетельствует ФВ ЛЖ ≥50%. СВ можно оценить по скорости движения контуров аорты или ЛА. При допплеровском исследовании можно по струе трикуспидальной регургитации определить ДЛА и мониторировать преднагрузку ЛЖ. Однако достоверность этих измерений при ОСН не была верифицирована с помощью катетеризации правых отделов сердца. При получении недостаточно чёткого изображения при трансторакальном доступе, осложнённом клапанном поражении, подозрении на неисправность протеза митрального клапана, для исключения тромбоза ушка левого предсердия при высоком риске тромбоэмболии используется чрезпищеводная ЭХО КГ.
При нарушениях коронарного кровообращения необходима коронароангиография. Это исследование часто показано при длительно сохраняющейся ОСН, причину которой не удаётся определить с помощью других методов исследования.
Катетеризация лёгочной артерии с помощью плавающего катетера помогает дифференцировать кардиогенные и некардиогенные причины СН у больных с сочетанной патологией сердца и лёгких. Метод используется для измерения ДЗЛА, СВ и других гемодинамических параметров.
В настоящее время полностью доказана тесная связь между тяжестью сердечной дисфункции (прежде всего ЛЖ) и содержанием натрий- уретических пептидов в плазме, что позволяет рекомендовать определение концентрации этих пептидов в качестве «лабораторного теста» СН. Наиболее полно охарактеризованы N-концевой предсердный натрий- уретический пептид (ПНП), мозговой натрий- уретический пептид (МНУП или BNP) и его предшественник, N-концевой МНУП (NT-proBNP)
Лечение
В лечении острой декомпенсации ХСН ставятся следующие задачи:
I. Клинические:
- Ослабление или исчезновение симптомов: одышки и/ или утомляемости;
- Уменьшение выраженности физических проявлений;
- Снижение массы тела при наличии застоя крови олигурии;
- Увеличение диуреза при наличии застоя крови и/ или олигурии;
- Улучшение оксигенации тканей;
II. Гемодинамические:
- Снижение ДЗЛА до 18 мм.рт.ст. и менее;
- Увеличение СВ и/ или ударного объёма;
III. Исходы заболевания:
- Уменьшение продолжительности внутривенной инфузии вазоактивных препаратов;
- Сокращение сроков пребывания в отделении интенсивной терапии;
- Уменьшение длительности госпитализации;
- Увеличение времени до повторной госпитализации;
- Снижение смертности;
IV. Лабораторные:
- Нормализация содержания электролитов в крови;
- Снижение уровней остаточного азота и/ или креатинина;
- Уменьшение содержания билирубина;
- Снижение концентрации BNP и NT-pro-BNP в плазме крови;
- Нормализация уровня глюкозы в крови.
Основной целью лечения служит снижение смертности.
Первоочередные меры включают:
-использование высоких концентраций кислорода
-введение промедола 2% - 1мл (20мг) или морфина гидрохлорида 1%-1мл(10мг) вв (анксиолитический эффект, подавление дыхательного центра, обезболивание). При передозировке внутривенно вводят налоксон 0,4 мг (1 мл).
-нитраты (спрэй нитроглицерина сублингвально с последующим переходом на внутривенное введение)
-диуретики (показаны при несомненной перегрузке внутрисосудистым объемом у «влажных теплых» больных (80-120 мг вв).
-левосимендан - новый фармакологический препарат, улучшает СВ посредством сенсибилизации к кальцию (усиливает сократимость миокарда при неизменном уровне внутриклеточного кальция, т.е. улучшает механическую эффективность сокращения) и периферического вазодилатирующего эффекта(за счет открытия АТФ- зависимых калиевых каналов). Инфузионное введение в течение суток обеспечивает улучшение гемодинамики до 5 дней.
-инотропные препараты показаны только при критическом снижении АД (менее 80-90ммртст,а для больных с артериальной гипертензией менее 100-110 мм.рт.ст.), 2-10 мкгкгмин вв шприцевым дозатором или .
-гипотензивные препараты при отеке легких с выраженной артериальной гипертензией
-с целью профилактики тромбозов показано введение: аспирин-кардио 325 мг, прямых антикоагулянтов (гепарин 5 тыс. ЕД 4-6 раз в сутки (ИМ)
- тромболитики в первые 0,5-2 часа при ИМ (стрептокиназа 1500млн ЕД капельно в 100 мл 0,9% раствора NaCl в течение 1 часа(ИМ)
- к методам механической поддержки кровообращения относят:
Неинвазивная или инвазивная ИВЛ с положительным давлением в дыхательных путях.
Положительные эффекты: уменьшение работы дыхания и снижение постнагрузки на левый желудочек.
ВАБК-внутриаортальная баллонная контрпульсация. Сфера использования ограничивается специализированными кардиоторакальными центрами.
Оксигенотерапия и респираторная поддержка
Важнейшей задачей в лечении ОСН является обеспечение адекватной оксигенации тканей для предупреждения их дисфункции и развития полиорганной недостаточности. Для этого крайне важно поддерживать рO2 артериальной крови в нормальных пределах (95-98%).
Оксигенотерапия. У больных с гипоксемией следует убедиться в отсутствии нарушенной проходимости дыхательных путей, затем начать оксигенотерапию с повышенным содержанием O2 в дыхательной смеси, которое при необходимости увеличивают. Целесообразность применения повышенных концентраций O2 у больных без гипоксемии спорна, такой подход может быть опасным.
Дыхательная поддержка без эндотрахеальной интубации (неинвазивная вентиляция легких). Для дыхательной поддержки без интубации трахеи в основном применяют два режима:
- режим поддержания ППД в дыхательных путях (continuous positive airway pressure - CPAP);
- режим НВПД (non-invasive positive pressure ventilation - NIPPV).
Использование ППД способно восстановить функцию легких и повысить функциональный остаточный объем. При этом улучшается податливость легких, уменьшается градиент трансдиафрагмального давления, снижается активность диафрагмы. Все это уменьшает работу, связанную с дыханием, и снижает метаболические потребности организма. НВПД - более сложная методика, требующая использования специального аппарата, обеспечивающего подачу определенного объема воздуха (O2 или смеси) до заранее установленного давления через маску. Добавление режима ПДКВ позволяет проводить поддержку по типу ППД (двухуровневая поддержка с положительным давлением, bilevel positive pressure support - BiPAP). Физиологическая польза данного режима вентиляции сходна с ППД, однако обеспечивает также поддержку вдоха, что еще больше уменьшает энергетические затраты на дыхание и метаболические запросы организма.
Использование неинвазивных методов у больных с кардиогенным отеком легких улучшает рO2 артериальной крови, уменьшает симптоматику ОСН, позволяет заметно снизить необходимость в интубации трахеи и ИВЛ.
Дыхательная поддержка с эндотрахеальной интубацией
Инвазивную дыхательную поддержку (ИВЛ с интубацией трахеи) не следует использовать для лечения гипоксемии, которую удается устранить оксигенотерапией и неинвазивными методами вентиляции легких.
Показаниями к ИВЛ с интубацией трахеи являются следующие:
- признаки слабости дыхательных мышц - уменьшение частоты дыхания в сочетании с нарастанием гиперкапнии и угнетением сознания;
- тяжелое нарушение дыхания (с целью уменьшить работу дыхания);
- необходимость защиты дыхательных путей от регургитации желудочного содержимого;
- устранение гиперкапнии и гипоксемии у больных без сознания после длительных реанимационных мероприятий или введения лекарственных средств;
- необходимость санации трахеобронхиального дерева для предупреждения обтурации бронхов и ателектазов.
Необходимость в немедленной инвазивной вентиляции может возникнуть при отеке легких на фоне ОКС.
Диуретики.
Диуретики показаны при ОСН с симптомами задержки жидкости.
Внутривенное введение петлевых диуретиков оказывает одновременно вазодилатирующее действие, проявляющееся быстрым (через 5-30 мин.) снижением давления в правом предсердии и ДЗЛА, а также уменьшением легочного сосудистого сопротивления. При болюсном введении высоких доз фуросемида, превышающих 1 мг/кг, существует риск рефлекторной вазоконстрикции. Это необходимо учитывать, особенно у больных с ОКС, когда диуретики желательно использовать в малых дозах, отдавая предпочтение вазодилататорам. При тяжёлой декомпенсации СН диуретики способствуют нормализации давления заполнения камер сердца и могут быстро уменьшить нейрогормональную активность.
Средствами выбора являются петлевые диуретики, которые оказывают выраженное мочегонное действие. Лечение можно начать на догоспитальном этапе. В дальнейшем следует титровать дозу до достижения клинического эффекта и уменьшения симптомов задержки жидкости. Введение ударной дозы фуросемида с последующей инфузией более эффективно чем повторное болюсное введение.
Применение диуретиков при ОСН:
- Начальные дозы подбирают с учётом клинического состояния.
- Титрование дозы в зависимости от клинического ответа.
- Снижение дозы при уменьшении степени выраженности задержки жидкости.
- Мониторирование уровня калия и натрия в сыворотке крови, а также функции почек (каждые 1-2 сут.) в зависимости от реакции на лечение.
- Коррекция потерь калия и магния.
Новый диуретик торасемид- самый эффективный из современных петлевых диуретиков. Биоусвояемость торасемида достигает 80-90%, что в два раза выше, чем у фуросемида. Это и определяет его предсказуемый мочегонный эффект. Торасемид, ингибируя реабсорбцию ионов натрия, калия и хлора, одновременно блокирует эффекты альдостерона, и благодаря этому в меньшей степени чем фуросемид, способствует экскреции калия. Торасемид на 80% метаболизируется печенью, поэтому нарушения функции почек практически не сказываются на фармакодинамических свойствах.
Тиазидные диуретики и спиронолактон могут использоваться в сочетании с петлевыми диуретиками. Сочетание низких доз препаратов более эффективно и сопряжено с меньшим риском возникновения побочных эффектов по сравнению с введением высоких доз одного диуретика. Сочетание петлевых диуретиков с добутамином, и допамином или нитратами более эффективно и безопасно, чем монотерапия диуретиком в более высоких дозах.
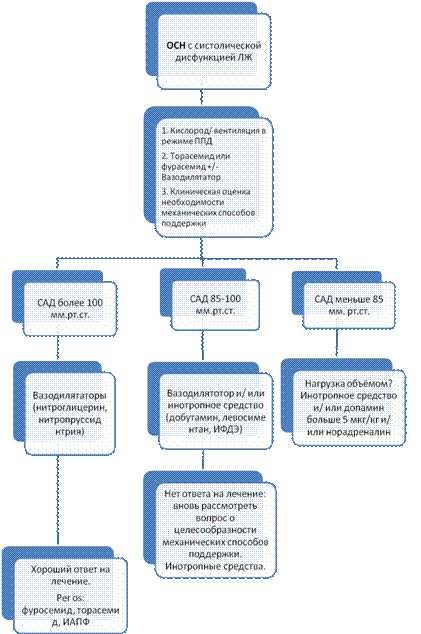
Рис. 1. Использование инотропных средств пи ОСН
Практическая часть
Цель исследования: Изучить эффективность инфузионного режима введения петлевых диуретиков (в частности лазикса) в сравнении с болюсным режимом введения, у больных с острой декомпенсацией ХСН.
Материал и методы исследования: В работу включены больные с ХСН 2Б ФК 4, поступившие в ПИТ с отёком лёгких, приступом кардиальной астмы, массивными отёками. Из исследования исключены больные с декомпенсацией ХСН на фоне острого воспалительного процесса, а также больные с декомпенсированной ХСН на фоне острого инфаркта миокарда.
В исследование включены 57 пациентов, из них 37 пациентов находились на инфузионном режиме введения лазикса (они составили исследуемую группу), 20 пациентов получали лазикс болюсно (контрольная группа).
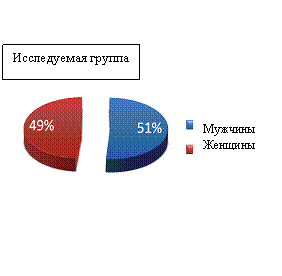
Среди пациентов контрольной группы преобладали женщины, пациенты исследуемой группы по полу распределились примерно равномерно:
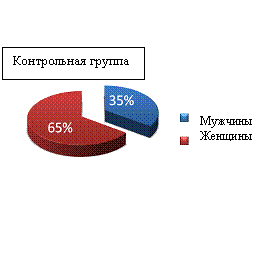
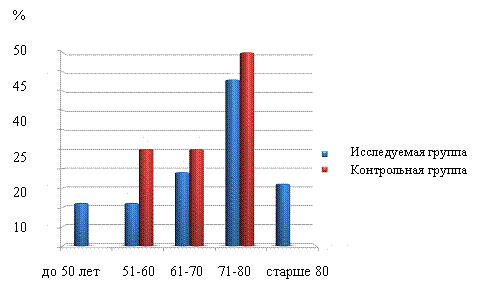
Среди пациентов обеих групп преобладали лица от 71 до 80 лет:
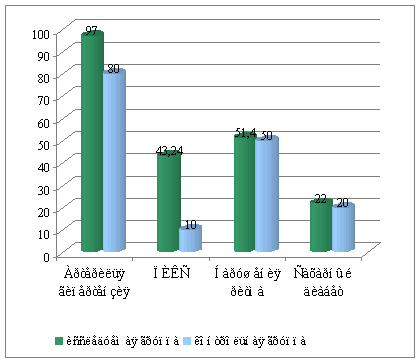
У пациентов обеих групп был выявлен ряд заболеваний, которые явились причиной развития у них ХСН. Практически у всех пациентов была диагностирована ИБС, у абсолютного большинства была выявлена АГ:
В ходе исследования проводилась оценка:
- клинических данных (ЧДД, наличие одышки, отёков, ЧСС, АД)
- биохимических показателей (в том числе, электролитного состава крови, показателей системы гемостаза)
- данных ЭКГ и ЭХО КГ.
- данных анамнеза (по ИБС, АГ и ХСН)
- длительности пребывания в ПИТ и в стационаре
Исходно, тяжесть состояния больных в обеих группах одинакова.
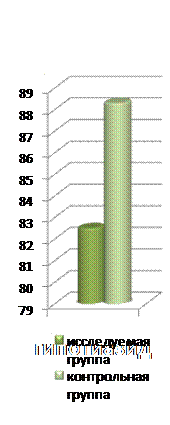
Разница в средней ФВ ЛЖ между пациентами обеих групп незначительна, что подтверждается критерием Стьюдента (р=0,112).

В течение всего периода пребывания в ПИТ, больные получали:
- кардиометаболитическую терапию
- нитраты
- дезагреганты
- антикоагулянты
- БАБ
- ингибиторы АПФ
- антагонисты Са
- диуретики: верошпирон, гипотиазид, лазикс.
Средняя суточная доза лазикса дл пациентов исследуемой группы была ниже в среднем на 30 мг (достоверность разницы подтверждается критерием Стьюдента р=0,04).
Гипотиазид Лазикс Верошпирон

Купирование клинических симптомов декомпенсации ХСН у пациентов исследуемой группы происходило быстрее, в результате чего они быстрее переводились из ПИТ в терапевтический стационар и быстрее выписывались из стационара.
 Средняя продолжительность пребыванияпациентов в ПИТ
Средняя продолжительность пребыванияпациентов в ПИТ
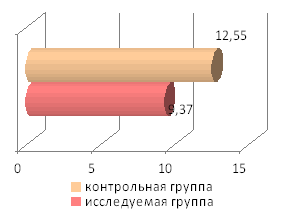 Средняя продолжительность пребывания пациентов в ПИТ
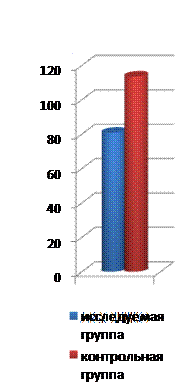
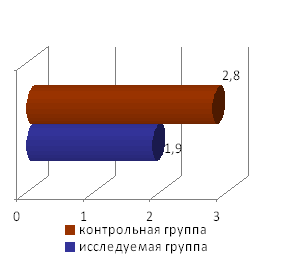
Средняя продолжительность пребывания пациентов в ПИТДлительность пребывания в ПИТ для пациентов исследуемой группы составила в среднем 1,92 суток, для пациентов контрольной группы- 2,82 суток. Длительность лечения в стационаре составила в среднем 9,4 суток в исследуемой группе и 12,55 суток в контрольной.
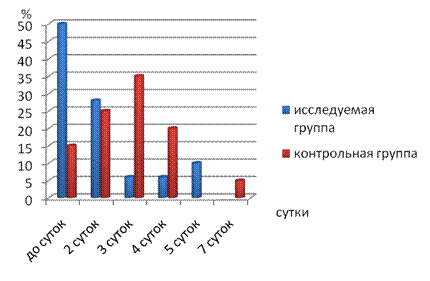
Для 50 % исследуемой группы и 15 % контрольной группы пребывание в ПИТ составило менее суток.
Для 28 % и 25% соответственно до 2 суток.
Для 6% и 35% до3 суток.
Для 6% и 20% до 4 суток.
Для 10% исследуемой группы составило 5 суток. Для 5% контрольной группы - 7суток.
Вследствие сокращения количества койко-дней у пациентов с инфузионным режимом введения лазикса на одного пациента затрачивается в среднем на 7800рублей меньше.
|
|
Средняя продолжительность лечения в ПИТ (сутки) |
Стоимость 1 суток пребывания в ПИТ (рубли) |
Общая стоимость пребывания в ПИТ (рубли) |
|
Исследуемая группа |
2 |
5817 |
11634 |
|
Контрольная группа |
3 |
5817 |
17451 |
|
|
Средняя продолжительность лечения в терапевтическом отделении (сутки) |
Стоимость 1 суток пребывания в терапевтическом отделении (рубли) |
Общая стоимость пребывания в терапевтическом отделении (рубли) |
|
Исследуемая группа |
7,37 |
908 |
6692 |
|
Контрольная группа |
9,55 |
908 |
8671 |
|
|
Средняя стоимость пребывания в ПИТ |
Средняя стоимость пребывания в терапевтическом отделении |
Общая стоимость лечения |
Разница в затратах на лечение (рубли) |
|
Исследуемая группа |
11634 |
6692 |
18326 |
|
|
Контрольная группа |
17453 |
8671 |
26124 |
|
|
Итого: |
|
|
|
7798 |
Таким образом, в ходе исследования были получены следующее результаты:
ü Купирование клинических симптомов декомпенсации ХСН быстрее происходило у пациентов исследуемой группы, в сравнении с пациентами контрольной группы, благодаря этому они быстрее переводились из АРО в терапевтический стационар.
ü Длительность пребывания в АРО у пациентов исследуемой группы в среднем оказалась на 1 сутки меньше, чем у пациентов контрольной группы (1,92 суток в исследуемой группе и- 2,82 суток в контрольной группе)
ü Длительность лечения в стационаре составила для пациентов исследуемой группы в среднем на 3 суток меньше (9,4 суток в исследуемой группе и 12,55 суток в контрольной).
ü Средняя суточная доза лазикса в исследуемой группе была ниже в среднем на 30 мг (113,5 мг/сутки в среднем для контрольной группы и 80,86 мг/сутки для исследуемой группы).
ü В результате более быстрого перевода пациентов, находящихся на инфузионном режиме введения лазикса, из АРО и более быстрой их выписки из стационара на одного пациента в среднем затрачивается на 7798 рубль меньше.
Обсуждение:
Лазикс является основным представителем петлевых диуретиков. Оказывает мощный диуретический эффект, а также вызывает дилатацию переферических сосудов. Механизм диуретического действия основан на следующих изменениях:
1) За счёт увеличения синтеза простагландинов в почках усиливается почечный кровоток, а следовательно и клубочковая фильтрация.
2) В результате взаимодействия лазикса с сульфгидрильными группами эпителиальных клеток восходящей части петли Генле уменьшается энергообеспечение ионных насосов на базальной мембране клеток канальцев, благодаря этому тормозится активная реабсорбция натрия и хлора.
Дилатация переферических сосудов происходит в результате прямого действия лазикса на эндотелий сосудов, при этом нормализуется соотношение между внутриклеточным содержанием натрия и внеклеточным. Также меняется реактивность сосудистой системы, уменьшаются прессорные реакции на сосудосуживающие вещества.
При болюсном введении высоких доз лазикса существует риск развития рефлекторной вазоконстрикции (феномен «рикошета»). Феномен обусловлен резкой активацией РААС и других антинатрийуретических нейрогуморальных звеньев регуляции в ответ на массивный диурез. Стимулирует аргинин- вазопрессивную и симпатическую систему, уменьшает уровень предсердного натрийуретического фактора в плазме, вызывает вазоконстрикцию.
При использовании диуретической терапии возможно развитие устойчивости к диуретикам (это состояния, при котором клинический ответ на лечение снижается или полностью исчезает раньше, чем устраняются симптомы задержки жидкости. Её развитие связано с неблагоприятным прогнозом). Наиболее часто она наблюдается у больных с тяжёлой ХСН при длительном лечении диуретиками, а также при острой гиповолемии после внутривенного введения петлевых диуретиков. Возможные причины её развития: уменьшение внутрисосудистого объёма, нейрогормональная активация, реабсорбция натрия при гиповолемии, снижение канальцевой секреции (почечная недостаточность, приём НПВС), снижение перфузии почек при низком СВ. При болюсном введении высоких доз лазикса риск развития устойчивости к диуретикам выше, чем при инфузионном режиме введения препарата.
Одномоментное введение высоких доз оказывает токсическое действие на клубочки почек, в результате этого часть клубочков гибнет сразу после введения препарата. При инфузионном введении концентрация препарата в крови ниже, благодаря этому токсичного действия не происходит.
При инфузионном режиме введения поддерживается постоянная концентрация лазикса в сыворотке крови, вследствие этого выраженный терапевтический эффект сохраняется дольше.
Таким образом, при применении инфузионного режима введения лазикса оказывается меньшее влияние на гемодинамику и ионный баланс крови, при этом риск развития осложнений и лекарственной устойчивости ниже.
Заключение:
Инфузионный режим введения лазикса по сравнению с болюсным режимом позволяет опитмизировать диуретическую терапию у пациентов с острой декомпенсацией ХСН.
Пациенты с острой декомпенсацией ХСН, получившие инфузионную терапию, на 1 сутки раньше переводились из отделения реанимации и в целом имели меньший койко-день (в среднем на 3 суток) по сравнению с пациентами, получившими лазикс болюсно.
Инфузионный режим диуретической терапии экономически целесообразен, так как позволяет значительно сократить расходы на лечение пациентов с острой декомпенсацией ХСН.
СПИСОК ЛИТЕРАТУРЫ
1. Всероссийское научное общество кардиологов «Кардиология» Национальное руководство 2007.. Гл. 21;
2. Браунвальд Е. Болезни, лечение болезни. Гл. 182.;
3. Steven J. Allen, M.D. The University of Texas Medical School, Хьюстон, штат Техас 77030 ASA Refresher Courses on Anesthesiology, Volume 22, 1994, Chapter 1.
4. Программа национального научно- практического общества СМП, А.К. Стародубцев, Д.Е. Архипова. Качественная клиническая практика 2002;
5. Малишевский М.В, Кашуба Э.А., Ортенберг Э.А, Бышевский А.Ш., Баркова Э.Н. Внутренние болезни. 2004. Часть 3.
6. Регистр лекарственных средств России РЛС Энциклопедия лекарств.- 15 выпуск / Гл. редактор Г.Л. Вышковский. 2007.



