где U - напряжение, L0 - толщина, до которой был выращен оксидный слой в ГС режиме, j0 - плотность тока в гальваностатическом режиме.
С помощью системы уравнений (1-5) [3] можно рассчитать динамику изменения концентрации подвижных носителей заряда по толщине анодной окисной пленки в процессе ВС режима. Граничные условия приобретают следующий вид с (L, 0) U(t) = const.
(1)
-γ∙с(x,t)∙c0 (2)
(3)
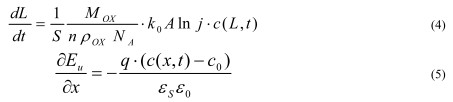
где c(x,t)- концентрация подвижных ионов, cо(x) - концентрация неподвижных дефектов решетки, D, μ, - соответственно коэффициент диффузии, подвижность ионов, а Ε - напряженность электрического поля, кo - константа скорости роста окисла, MOX - молярная масса образующегося оксида, ρOX - плотность оксида, NA - число Авогадро, nox - валентность реакции образования окисла, с(x,t) - концентрация подвижных ионов в окисле, Eи - поле заряда подвижных чаcтиц, γ - сечение рекомбинации.
В уравнениях учитывается логарифмическая зависимость скорости реакции на границе металл-окисел от плотности тока и взаимодействие подвижных частиц с дефектами решетки. Результаты решения приведены на рис. 1. Как видно из приведенных зависимостей в окисле после ВС режима остается часть подвижных частиц, не вступивших во взаимодействие с решеткой окисла и не успевших дойти до границы, где образуются новые слои окисла за время 300 с (кривая 4).
Данная модель позволяет находить распределение остаточной концентрации катионов металла по толщине окисной пленки. Эти частицы образуют заряд, который является причиной отсутствия модуляции емкости МДП структур сразу после анодного окисления. При меньших токах формирования окисла в ГС система быстрее приходит в равновесное состояние после выдержки при постоянном напряжении.
В вольтстатическом режиме уменьшение тока и соответственно скорости химической реакции приводит к меньшему числу дефектов на межфазной границе Si -Ta2O5, таким образом, снижается начальная плотность поверхностных состояний, которая проявляется в измерениях C-V характеристик после отжига МДП структур (2000С, 10 мин).
Представленные расчеты позволяют получить качественную картину, объясняющую снижение встроенного заряда и плотности поверхностных состояний в системе полупроводник анодный окисел металла.
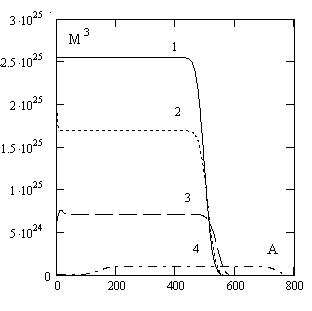
Рис. 1. Распределение концентрации носителей по толщине окисла после перехода системы в ВС режим за интервалы времени: 1 - 1 с; 2 - 2 с; 3 - 10 с; 4 - 300 с.
СПИСОК ЛИТЕРАТУРЫ:
- Л. Юнг. "Анодные окисные пленки" //Л.:Энергия, 1967
- Л. Л. Одынец, В.М. Орлов. "Анодные окисные пленки", Ленинград, "Наука", 1990.
- Н.А. Авдеев, Г.С. Сиговцев. "О математических моделях процессов анодного окисления"// Труды Петрозаводского государственного университета: сер. Прикладная математика и информатика. Вып.9./ Под.науч. ред. Проф. В. И. Чернецкого // ПетрГУ. Петрозаводск, 2000, с 57.



