Целью настоящей работы явилось определение кинетических характеристик реакции окисления СО кислородом воздуха на CdTe, CdHgTe, CdS и уточнение механизма данного процесса.
Каталитическое окисление СО осуществляли при температурах 373-431К на проточно-циркуляционной установке при скорости циркуляции 56 мл/мин и объёме циркуляционного контура 36,6 см3. Состав продуктов контролировали хроматографическим методом.
Активность катализаторов определяли отношением констант скоростей каталитической и гомогенной некаталитической реакций. При определении константы скорости некаталитической реакции для поддержания в реакторе условий, близких к режиму идеального вытеснения, последний заполнялся стеклянным порошком фракции 0,01 мм с длиной слоя, равной длине слоя катализатора.
На основе полученных опытных зависимостей определяли такие кинетические характеристики, как константа скорости, энергия активации, температурный коэффициент реакции.
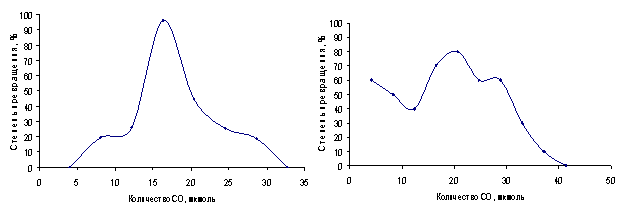
Рис. 1. Зависимость степени превращения СО на CdTe (а) и CdHgTe (б) от количества введенного в реактор СО при Vоб = 8,5 мл/мин и температуре 423 К. Газ-носитель - воздух.
На рис. 1 представлены кривые конверсии СО на CdTe и CdHgTe при 423 К после однократного прохождения газо-воздушной смеси через слой катализатора. Нисходящие участки этих кривых указывают на наличие адсорбции продуктов реакции на зёрнах катализатора и затруднительный их отвод в поток газа-носителя. При меньшей конвертируемости CO на CdHgTe, по сравнению с CdTe, отмечается более высокая адсорбционная ёмкость его по отношению к продуктам катализа. Это можно объяснить, опираясь на известные представления о природе адсорбционных активных центров на алмазоподобных полупроводниках [2, 3]. Согласно таковым, в роли первичных активных центров для молекул СО и СО2 на алмазоподобных полупроводниках выступают преимущественно координационно-ненасыщенные атомы металла. На CdHgTe, в отличие от CdTe, содержится два типа металлических атомов, обладающих комплексообразующей способностью. Отсюда повышенная адсорб ционная ёмкость CdHgTe к указанным газам-адсорбатам.
Из данных, представленных в таблице, следует, что повышение температуры оказывает значительное влияние на скорость процесса, протекающего как в кинетической, так и во внешнедиффузионной областях. Так при повышении температуры на 50 К скорость реакции на CdTe увеличивается в три раза, а на CdHgTe и CdS уменьшается в 1,26÷2 раза. Cоответственно с повышением температуры активность CdTe растёт, а активность CdHgTe и CdS падает. В диффузионной области константа скорости является функцией коэффициента диффузии, который в свою очередь зависит от температуры. Так, с повышением температуры от 377 до 423 К коэффициент молекулярной диффузии увеличивается от 1,5678∙10-4 до 1,9847∙10-4 м2/c.
Таблица 1. Кинетические характеристики реакции окисления оксида углерода (II)
|
Константа скорости реакции Кср.., с-1 |
CdTe |
CdHgTe |
CdS |
Стеклян. порошок |
||||
|
377 К |
423 К |
373 К |
431 К |
373 К |
423 К |
373 К |
423 К |
|
|
0,00504 |
0,01505 |
0,00564 |
0,00446 |
0,0063 |
0,0031 |
0,0023 |
0,00288 |
|
|
Активность А |
2,191 |
5,2257 |
2,452 |
1,548 |
2,739 |
1,076 |
- |
|
|
Энергия активации Е, кДж/моль |
3,441 |
0,084 |
3,118 |
4,332 |
2,775 |
5,641 |
5,899 |
|
|
Снижение энергии активации каталитической реакции ΔE, кДж/моль |
2,459 |
5,815 |
2,781 |
1,567 |
3,124 |
0,259 |
- |
|
|
Температурный коэффициент γ |
1,2687 |
0,9603 |
1,1523 |
1,0459 |
||||
Численные значения температурных коэффициентов скорости реакции на CdTe, CdHgTe, CdS и стеклянном порошке значительно меньше таковых для кинетической области и по порядку величин соответствуют области внешней диффузии. Изменения энергии активации реакции с температурой могут быть связаны либо с диффузионными транспортными процессами, либо с химическими превращениями катализаторов при взаимодействии с реакционной средой. Так, при химическом и хроматографическом анализах состава конвертируемой газовой смеси, прошедшей многократно через катализаторы, в продуктах реакции при начальных концентрациях СО 1,68 - 8,2 об.% оксид углерода (IV) не обнаружен, что скорее всего обусловлено его сильной адсорбцией катализаторами. Согласно работам [1-3], в данном каталитическом процессе участвуют адсорбированный кислород в форме ион-радикалов О2- , О- и поверхностные атомы металла, а совместная адсорбция СО и О2 протекает преимущественно по ударному механизму с образованием адсорбированных частиц СО2. В соответствии со сказанным, механизм изученного процесса каталитического окисления СО можно представить следующей схемой:
СО (газ) + А → ![]() (адс)
(адс)
![]() (адс) + е → СО- (адс) +А
(адс) + е → СО- (адс) +А
СО- (адс) + О2- (адс) → СО32- (адс)
СО32- (адс) → СО2 (адс) + О- (адс) + е
Наличие поверхностной ртути на CdHgTe и элементарной серы на CdS снижает их каталитическую активность за счёт увеличения парциального давления данных элементов при нагревании и адсорбции на активных участках катализатора.
СПИСОК ЛИТЕРАТУРЫ:
- Кировская И.А., Федяева О.А., Миронова Е.В. Адсорбционные и каталитические свойства теллурида кадмия в реакции окисления монооксида углерода./ Омский научный вестник. 2003. №4 (25).
- Кировская И.А. Поверхностные свойства алмазоподобных полупроводников. Химический состав поверхности. Катализ. - Иркутск: Изд-во Иркут. ун-та, 1984. 220 с.
- Кировская И.А. Поверхностные свойства алмазоподобных полупроводников. Адсорбция газов. Иркутск. 1984, 139c.



