Катализаторы представляли собой порошки (фракция 0,01-0,02 мм) и пленки (d = 0,25-0,35 мкм) InSb, InP, CdTe, CdS и твердых растворов замещения систем InSb-CdTe, InSb-CdS, InP-CdS различного состава, полученных методом изотермической диффузии в областях взаимной растворимости бинарных компонентов [1]. Пленки готовили дискретным напылением в вакууме (Тконд = 298 К, Р = 1,33∙10-3 Па) на электродные площадки пьезокварцевых резонаторов с последующим отжигом в парах сырьевого материала [2].
Каталитические исследования осуществляли безграндиентными импульсным проточным и проточно-циркуляционным методами [3] в условиях, исключающих влияние процессов массо- и теплопередачи: Т = 290-473 К; Р = 101-103 кПа; объемная скорость газа-носителя 8-26 мл/мин; объем импульса 0,5-1,5 мл. Для обеспечения в проточном реакторе режима идеального вытеснения соблюдались специально разработанные правила и приемы [4].
В качестве газа-носителя использовали преимущественно аргон (для сравнения - воздух). Газы-реагенты (СО, О2, NO2, NH3) получали по известным методикам [3, 5], реакционные смеси готовили в соотношениях:
СО : О2 = 1 : 2 и NO2 : NH3 = 1 : 2.
Удельную каталитическую активность оценивали по удельной скорости реакции при заданной температуре и составе реакционной смеси.
Протекание реакций окисления оксида углерода и восстановления оксида азота аммиаком контролировали соответственно по изменению содержания СО2, СО и NО2, NО в реакционных смесях.
Для предварительного установления температурных областей протекания изучаемых реакций и дальнейшего выяснения их механизма были исследованы индивидуальная и совместная адсорбция участников реакций. Эти исследования осуществляли волюмо- и гравиметрическим (пьезокварцевое микровзвешивание с чувствительностью до 1,23∙10-11 кг/см2 Гц) методами [3, 6] в интервалах температур 243-473 К и давлений 0,5-20 Па.
Об изменении электронного состояния поверхности в процессе адсорбции судили по изменению электропроводности, которую измеряли зондовым методом [3].
Детали каталитических, адсорбционных и электрофизических экспериментов подробно описаны в [3, 6].
Фрагменты основных результатов выполненных каталитических исследований представлены на рис. 1, 2 и в табл. 1.
Наиболее активными по отношению к реакции окисления СО (степень превращения 82-96 %) оказались: при Т = 373-423 К - InP и твердый раствор (InSb)0,05 (CdTe)0,95 ; при Т < 373 К - твердый раствор (InP)0,95(CdS)0,05.
Что касается реакции восстановления NO2 аммиаком, то здесь обращает на себя внимание высокая каталитическая активность (80-96 %) уже при комнатной температуре InSb, CdTe и твердого раствора (InSb)0,03(CdS)0,97. При повышении температуры до 313 К InSb уступает по активности свое место твердому раствору (InSb)0,98(CdS)0,02.
Совпадение общего и частного порядков реакции (частный порядок по СО равен единице), независимость скорости окисления СО от концентрации кислорода в газовой фазе указывает на нулевой порядок по кислороду.
Таблица 1. Каталитическое восстановление NO2 аммиаком на компонентах системы InSb-CdTe при составе исходной смеси NO2 : NH3 = 1 : 2
|
№ опыта |
Содержание NO2 на входе в реактор, мкг |
Содержание NO2 на выходе из реактора, мкг |
Степень превращения NО2, % |
|
CdTe |
|||
|
1 |
16,49 |
8,51 |
48,39 |
|
2 |
16,49 |
4,26 |
74,19 |
|
3 |
16,49 |
4,04 |
75,48 |
|
4 |
24,47 |
5,85 |
76,08 |
|
5 |
24,47 |
4,79 |
80,43 |
|
6 |
24,47 |
4,79 |
80,43 |
|
(InSb)0,03 (CdTe)0,97 |
|||
|
1 |
36,20 |
13,68 |
62,2 |
|
2 |
36,20 |
8,69 |
76,0 |
|
3 |
36,20 |
5,68 |
84,3 |
|
4 |
36,20 |
3,51 |
90,3 |
|
5 |
36,20 |
1,60 |
95,6 |
|
6 |
36,20 |
1,45 |
96,0 |
|
(InSb)0,05 (CdTe)0,95 |
|||
|
1 |
35,40 |
21,17 |
40,2 |
|
2 |
35,40 |
14,73 |
58,4 |
|
3 |
35,40 |
12,89 |
63,6 |
|
4 |
35,40 |
12,39 |
65,0 |
|
5 |
35,40 |
12,32 |
65,2 |
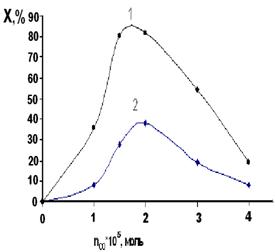
Рис. 1. Зависимость степени превращения СО на твердом растворе (InSb)0,05 (CdTe)0,95 (1) и теллуриде кадмия (2) от количества введенного в реактор СО при Т = 380 К и Vоб = 26 мл/мин
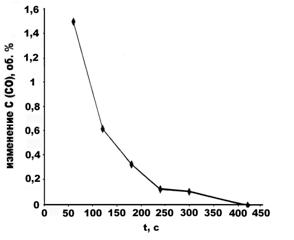
Рис. 2. Зависимость изменения концентрации оксида углерода (II) от времени на InP при 373 К
Принимая во внимание повышенную адсорбируемость в смеси СО + О2 оксида углерода, проявление им донорных свойств (положительное заряжение поверхности адсорбента), первый порядок реакции (по СО и общий), а также установленные в [7] механизмы адсорбции (с образованием СО2- ) и десорбции (в молекулярной форме) диоксида углерода - ожидаемого продукта взаимодействия СО и О2 и близкого по природе и поведению к СО, можно заключить, что адсорбция смеси СО + О2 и соответственно реакция окисления СО протекают преимущественно по ударному механизму, аналогичному предложенному в [3].
На основе адсорбционных и прямых каталитических исследований такой же механизм предложен и для каталитического восстановления NО2 аммиаком: сначала адсорбируется диоксид азота (как наиболее активный газ реакционной смеси с образованием донорно-акцепторных комплексов NO2+δ - A-δ (А - координационно-ненасыщенный атом). Затем в результате полной делокализации электрона в образующихся комплексах возможно образование ион-радикалов NO2-, которые будут взаимодействовать с молекулами аммиака, находящимися в газовой фазе.
СПИСОК ЛИТЕРАТУРЫ:
- Кировская И.А. Поверхностные свойства алмазоподобных полупроводников. Твердые растворы. Томск: Изд-во ТГУ, 1984. - 160 с.
- Тонкие пленки антимонида индия. Кишинев: Штиинца, 1989. - 162 с.
- Кировская И.А. Поверхностные свойства алмазоподобных полупроводников. Химический состав поверхности. Катализ. Иркутск: Изд-во ИГУ, 1988. - 220 с.
- Проблемы теории и практики исследований в области катализа / Под ред. В.А. Ройтера. - Киев: Наук.думка, 1973. - 364 с.
- Рапопорт Ф.М., Ильинская А.А. Лабораторные методы получения чистых газов. - М.: Госхимиздат, 1963.
- Кировская И.А. Адсорбционные процессы. - Иркутск: Изд-во ИГУ, 1995. - 300 с.
- Кировская И.А. Поверхностные свойства алмазоподобных полупроводников. Адсорбция газов. - Иркутск: Изд-во ИГУ, 1984. - 186 с.



