Поэтому система противодействия биотерроризму не может быть эффективной без постоянного мониторинга за свойствами циркулирующих в данном регионе штаммов возбудителей, которые отнесены к патогенным биологическим агентам и могут быть использованы при актах терроризма.
При проведении микробиологического мониторинга за циркулирующими в г. Ростове-на-Дону возбудителями сальмонеллезных инфекций и шигеллезов (2005-2006 гг.), помимо видового типирования, был определен спектр чувствительности-устойчивости к широкому кругу антибиотиков для анализа при осуществлении эпидемиологического надзора за резистентностью штаммов к антимикробным препаратам.
Для обработки результатов определения антибиотикорезистентности штаммов энтеробактерий была использована компьютерная программа WHONET 5.4, позволяющая определять механизмы развития устойчивости и эпидемиологию резистентных штаммов [3,4]. Дополнительным преимуществом этой программы является наличие встроенной системы BacTrack, информирующей о появлении необычных фенотипов резистентности при регистрации единичных больных и вспышек.
Таблица 1. Характеристика антибиотикорезистентности штаммов энтеробактерий.
|
Группы |
Антибиотики |
Shigella sonnei 13 штаммов |
Shigella flexneri 4 штамма |
Salmonella typhimurium 42 штамма |
Salmonella enteritidis 84 штамма |
|
|
Удельный вес резистентных (%) |
||||||
|
β-лактамы |
Пенициллины |
оксациллин |
100,0 |
100,0 |
100,0 |
100,0 |
|
ампициллин |
8,3 |
66,7 |
52,8 |
5,9 |
||
|
амоксициллин |
8,3 |
66,7 |
52,8 |
5,9 |
||
|
карбенициллин |
8,3 |
66,7 |
52,8 |
5,9 |
||
|
пиперациллин |
8,3 |
66,7 |
55,6 |
5,9 |
||
|
Цефалоспорины |
цефазолин |
0 |
0 |
36,1 |
4,4 |
|
|
цефалексин |
8,3 |
0 |
33,3 |
4,4 |
||
|
цефамандол |
0 |
0 |
33,3 |
2,9 |
||
|
цефуроксим |
0 |
0 |
36,1 |
4,4 |
||
|
цефаклор |
0 |
0 |
33,3 |
4,4 |
||
|
цефотаксим |
0 |
0 |
33,3 |
2,9 |
||
|
цефоперазон |
0 |
0 |
33,3 |
2,9 |
||
|
цефтриаксон |
0 |
0 |
38,9 |
2,9 |
||
|
цефтазидим |
0 |
0 |
19,4 |
1,5 |
||
|
цефепим |
0 |
0 |
33,3 |
2,9 |
||
|
Карбапенемы |
меропенем |
8,3 |
0 |
19,4 |
5,9 |
|
|
Аминогликозиды |
нетилмицин |
0 |
0 |
2,8 |
0 |
|
|
амикацин |
8,3 |
66,7 |
5,6 |
0 |
||
|
гентамицин |
0 |
66,7 |
55,6 |
2,9 |
||
|
тобрамицин |
16,7 |
33,3 |
45,7 |
5,9 |
||
|
сизомицин |
0 |
50,0 |
50,0 |
1,1 |
||
|
неомицин |
9,1 |
100,0 |
55,0 |
0 |
||
|
канамицин |
9,1 |
100,0 |
60,0 |
3,4 |
||
|
стрептомицин |
90,9 |
100,0 |
85,0 |
15,5 |
||
|
Хинолоны |
налидиксовая к-та |
0 |
0 |
22,2 |
14,7 |
|
|
Фторхинолоны |
пефлоксацин |
0 |
0 |
2,8 |
0 |
|
|
ципрофлоксацин |
0 |
0 |
0 |
0 |
||
|
левофлоксацин |
0 |
0 |
0 |
0 |
||
|
Тетрациклины |
доксициклин |
41,7 |
66,7 |
83,3 |
86,8 |
|
|
тетрациклин |
18,2 |
100,0 |
75,0 |
0 |
||
|
Нитрофураны |
фуразолидон |
58,3 |
66,7 |
80,6 |
97,0 |
|
|
Рифамицины |
рифампицин |
100,0 |
100,0 |
100,0 |
100,0 |
|
|
Полимиксины |
полимиксин В |
0 |
0 |
11,1 |
1,5 |
|
|
Хлорамфеникол |
левомицетин |
75,0 |
66,7 |
50,0 |
4,4 |
|
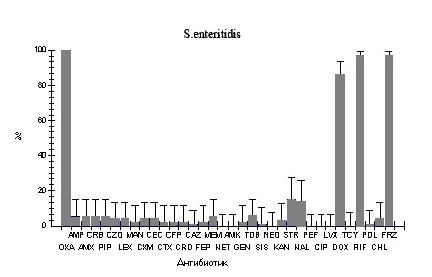
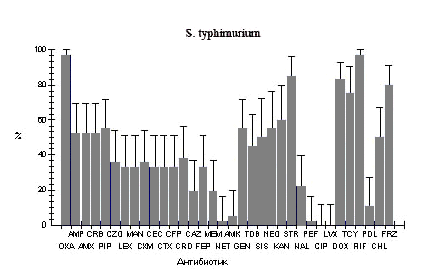
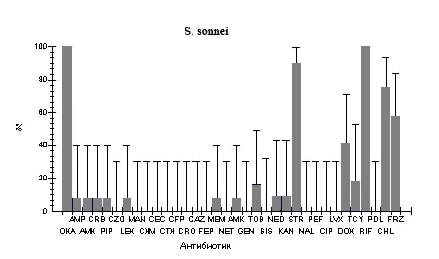
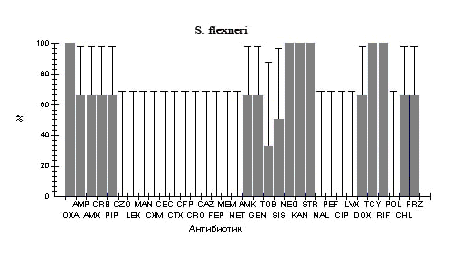
Рис.1. Фенотипы резистентности к антибиотикам у штаммов бактерий кишечной группы, выделенных от больных в г. Ростове-на-Дону в 2005-2006 гг.
Oxa - оксациллин; Amp - ампициллин; Amx - амоксициллин; Crb - карбенициллин; Pip - пиперациллин; Czo - цефазолин; Lex - цефалексин; Man - цефамандол; Cxm - цефуроксим; Cec - цефаклор; Ctx - цефотаксим; Cfp - цефоперазон; Cro - цефтриаксон; Caz - цефтазидим; Fep - цефепим; Mem - меропенем; Net - нетилмицин; Amk - амикацин; Gen - гентамицин; Tob - тобрамицин; Kan - канамицин; Str - стрептомицин; Nal - налидиксовая кислота; Pef - пефлоксацин; Cip - ципрофлоксацин; Lvx - левофлоксацин; Dox - доксициклин; Tcy - тетрациклин; Rif - рифампицин; Pol - полимиксин; Chl - хлорамфеникол.
Изучено 143 штамма шигелл и сальмонелл, выделенных от больных, госпитализированных в инфекционные отделения городской больницы №1 г. Ростова-на-Дону. Фенотипы резистентности к 34 антибиотикам представлены в таблице 1 и на рисунке. Все выделенные штаммы были резистентны к оксациллину и рифампицину. Кроме того, все штаммы S. flexneri оказались устойчивы к тетрациклину, стрептомицину, канамицину и неомицину, более 90% штаммов S. sonnei - к стрептомицину. При сравнении уровня резистентности шигелл видно, что по отношению к пенициллинам, аминогликозидам и тетрациклинам S. flexneri оказались более устойчивы, чем S. sonnei. При этом обращает на себя внимание, что штаммы обоих видов шигелл в большинстве своем чувствительны к цефалоспоринам, хинолонам, фторхинолонам и полимиксину.
Что касается сальмонелл, то представители видов S. typhimurium и S.enteritidis в 97-100% были чувствительны только к фторхинолонам. В 14,7-22,2% сальмонеллы были устойчивы к налидиксовой кислоте. В целом уровень резистентности S. typhimurium был выше, чем у S.enteritidis. Так по отношению к цефалоспоринам I-IV поколений у S. typhimurium оказались резистентными от 19,4% до 38,9% штаммов, в то время как уровень устойчивости у S.enteritidis колебался в пределах от 1,5% до 4,4%. Такая же картина наблюдалась при анализе резистентности к синтетическим и полусинтетическим пенициллинам (52,8-55,6% у S. typhimurium против 5,9% у S.enteritidis) и аминогликозидам (за исключением нетилмицина и амикацина, к которым большинство штаммов обоих видов оказалось чувствительным, резистентность S. typhimurium составляла 45,7-85%, а у S.enteritidis - от 0 до 15,5%.
Использование системы WHONET позволило исследовать выделенные штаммы по профилям резистентности к антибиотикам, используемым в клинике для лечения больных и определения механизмов резистентности. В препараты первого ряда включили ампициллин, амоксициллин, цефазолин, цефаклор, цефотаксим, цефтриаксон, цефтазидим, ципрофлоксацин, пиперациллин, меропенем, левофлоксацин. Характеристика профилей антибиотикорезистентности представлена в таблице 2.
Таблица 2. Характеристика профилей антибиотикорезистентности штаммов энтеробактерий
|
Профили резистентности |
Кол-во антибиотиков, к которым резистентны штаммы |
S. sonnei (%) |
S. flexneri (%) |
S. typhimurium (%) |
S. enteritidis (%) |
|
Чувствительные |
0 |
92 |
25 |
19 |
79 |
|
Z |
1 |
- |
25 |
2 |
- |
|
P |
1 |
- |
- |
11 |
1 |
|
M |
1 |
- |
- |
- |
3 |
|
C |
1 |
- |
- |
- |
1 |
|
R |
1 |
- |
- |
- |
1 |
|
F |
1 |
- |
- |
- |
1 |
|
PM |
2 |
- |
- |
- |
3 |
|
AX P |
3 |
- |
25 |
2 |
1 |
|
PZM |
3 |
- |
- |
2 |
- |
|
CPM |
3 |
- |
- |
- |
1 |
|
AXCP |
4 |
- |
25 |
6 |
- |
|
CTPC |
4 |
- |
- |
2 |
- |
|
AXPZ |
4 |
- |
- |
- |
1 |
|
CPCZM |
5 |
- |
- |
3 |
3 |
|
AXPCZ |
5 |
- |
- |
3 |
- |
|
CFTPCZ |
6 |
- |
- |
3 |
- |
|
ACPCZM |
6 |
- |
- |
3 |
- |
|
AXFTPM |
6 |
- |
- |
3 |
- |
|
АXCCPZM |
7 |
8 |
- |
2 |
- |
|
AXCFPCZ |
7 |
- |
- |
3 |
3 |
|
AXCFTPZM |
8 |
- |
- |
3 |
- |
|
AXCFTPCZ |
8 |
- |
- |
22 |
- |
|
AXCFTPCZM |
9 |
- |
- |
11 |
3 |
Условные обозначения:
A-ампициллин; X-амоксициллин; C-цефотаксим; F-цефтриаксон; T-цефтазидим; R-ципрофлоксацин; C-цефаклор; P-пиперациллин; Z-цефазолин; М-меропенем; L-левофлоксацин
По данным таблицы видно, что из штаммов S. sonnei только один (8%), выделенный от ребенка 1 года 4 месяцев, оказался резистентен к семи антибиотикам первого ряда (ампициллину, амоксициллину, пиперациллину, цефотаксиму, цефаклору, цефазолину и меропенему). Безусловно, появление такого штамма потребовало тщательного эпидемиологического расследования. Штаммов S.flexneri было исследовано всего четыре, поэтому представленные данные в процентах не совсем статистически корректны, однако даже при таком объеме видно, что в клинике встречались три антибиотикорезистентных варианта.
Максимальное разнообразие вариантов устойчивости к антибиотикам первого ряда наблюдалось у S. typhimurium. По два варианта характеризовались резистентностью к одному, трем, четырем, пяти семи и восьми антибиотикам, три варианта - к шести и один вариант был резистентен к девяти антибиотикам первого ряда. Наличие клонов, резистентных к цефалоспоринам III поколения - цефотаксиму, цефтриаксону и цефтазидиму - позволяет предположить, что эти штаммы продуцируют бета-лактамазы расширенного спектра (БЛРС), что может в результате привести к неэффективности лечения таких больных пенициллинами и цефалоспоринами I-IV поколений. При этом обращает на себя внимание, что в начале 2005 года выделялись штаммы S.typhimurium, резистентные к 1-3 антибиотикам, позднее и в 2006 году уровень резистентности возрос, что выразилось в появлении вариантов с множественной лекарственной устойчивостью (к 7-9 препаратам). Удельный вес таких штаммов достигал 22%.
Анализ динамики выделения S.enteritidis и спектра резистентности показал, что количество и удельный вес устойчивых вариантов было меньше, чем у S. typhimurium (12 против 16). Полирезистентные варианты выделялись только в апреле 2005 и 2006 гг. При этом во время вспышки сальмонеллеза в начале апреля 2006 года от больных детей выделяли, в основном, чувствительные к данной группе антибиотиков штаммы. Два высоко резистентных штамма были изолированы в конце апреля от больных старших возрастных групп. Проводится эпидемиологическое расследование.
Таким образом, на основании компьютерного анализа фенотипических профилей антибиотикоустойчивых штаммов шигелл и сальмонелл, выделенных в 2005-2006 гг. в г. Ростове-на-Дону, установлено, что данный метод может быть использован в системе эпидемиологического надзора при осуществлении мониторинга за распространением и динамикой циркулирующих возбудителей кишечных инфекций к антимикробным препаратам, что вносит свой вклад в совершенствование системы противодействия биотерроризму.
СПИСОК ЛИТЕРАТУРЫ:
- Онищенко Г.Г. Меры по противодействию биологическому терроризму в Российской Федерации // Журн. микробиол.- 2005, № 4.-С.33-37.
- Черкасский Б.Л. Сибирская язва как биологическое оружие.- М.: «ИнтерСЭН», 2002.- 40 с.
- Определение чувствительности микроорганизмов к антибактериальным препаратам // Методические указания МУК 4.2.1890-04.
- WHONET 5.4 Программное обеспечение базы данных микробиологической лаборатории // http://www.who.int/drugresistance/whonetsoftware/en/



