Материалы и методы: под наблюдением находилось 53 ребенка в возрасте от 1 до 14 лет; распределение детей по возрасту и полу представлено в таблице 1.
Анализ возраста пациентов показал, что ОЛЛ встречается во всех возрастных группах, но чаще у детей дошкольного возраста (37,6%), различия между группами достоверны χ2 = 19,544 (р<0,01). По полу пациенты распределялись следующим образом: девочек - 21 (39,6%), мальчиков - 32 (60,4%), различия между группами недостоверны χ2 = 2,28 (р>0,05).
Исследование системы гемостаза пациентам проводилось на высоте клинических проявлений (до начала лечения) и в динамике заболевания. Анализ клинических проявлений в дебюте заболевания представлен на рис. 1.
Таблица 1. Распределение детей с ОЛЛ по возрасту и полу
|
Пол |
Группа детей |
|||||
|
До 1 года |
1-3 года |
3-7 лет |
7-12 лет |
Старше 12 лет |
Всего |
|
|
Мальчики |
3 |
13 |
8 |
4 |
4 |
32 |
|
Девочки |
1 |
3 |
12 |
5 |
- |
21 |
|
Всего |
4 |
16 |
20 |
9 |
4 |
53 |
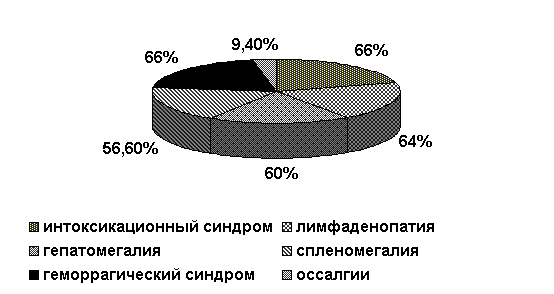
Рис. 1. Клинические проявления ОЛЛ в дебюте заболевания
Состояние системы гемостаза оценивалось по показателям активированного парциального тромбопластинового времени (АПТВ), протромбинового (ПТВ) по Quick (1935) и тромбинового времени (ТВ), эхитоксового времени (ЭВ); уровень растворимого фибрина в плазме оценивали с помощью орто-фенантролинового теста по Елыкомову В.А. и Момоту А.П., концентрацию фибриногена в плазме - по Clauss, активность антитромбина III - амидолитическим методом, скрининг нарушений в системе протеина С - по оценке нормализованного отношения (НО), XII-а зависимого лизиса эуглобулинов - по Еремину Г.Ф. и Архипову А.Г., лизис эуглобулиновой фракции плазмы при стимуляции стрептокиназой по Gidron et al. (1978) в модификации Лычева В.Г., Дорохова А.Е. с подсчетом индекса резерва плазминогена, уровень плазминогена амидолитическим способом [2].
Результаты проведенных нами ранее исследований системы гемостаза у детей с ОЛЛ на высоте клинических проявлений с помощью стандартизованных высокоинформативных методов показали наличие разнонаправленных сдвигов по уровню растворимых фибрин-мономерных комплексов (РФМК). В связи, с чем пациенты были разделены на две группы. Первую группу (1) составил 26 пациент, у которых уровень РФМК не превышал 150 мкг/мл, вторую группу (2) - 27 пациента с уровнем РФМК выше 150 мкг/мл.
Результаты
В дебюте заболевания, до химиотерапии, у больных обеих групп отмечался геморрагический синдром в виде петехий и экхимозов на коже, кровоизлияний на слизистых оболочках и имел одинаковую степень выраженности (2,3±0,1 и 2,3±0,3 балла соответственно, р>0,05)
Анализ показателей гемостаза (табл. 2) до лечения показал, что у больных 1 группы отмечалась тромбоцитопения, умеренная активация внутрисосудистого свертывания крови по показателям АТПВ и уровню тромбинемии, параллельно регистрировалась гипокоагуляция по ПТВ, ТВ, ЭВ и депрессия фибринолиза со снижением резерва и уровня плазминогена. Исходные показатели у пациентов группы 2 характеризовались также тромбоцитопенией, но у больных данной группы установлена выраженная активация внутрисосудистого свертывания крови по показателям АПТВ и уровню РФМК, снижение физиологических антикоагулянтов, сопровождающиеся, как и у больных группы 1 угнетением фибринолиза, снижением резерва и уровня плазминогена.
Таблица 2. Исходные показатели гемостаза у больных с ОЛЛ (Х ± m)
|
Методы исследования |
Результаты исследования |
||
|
Группа 1 |
Группа 2 |
Группа сравнения |
|
|
Количество тромбоцитов в крови, x109/л |
55,9±10,3* |
52,0±19,3* |
258,2±6,4 |
|
АПТВ, сек. |
30,6±1,2* |
34,4±1,4* |
37,6±0,4 |
|
ПТВ, сек. |
13,9±0,5* |
18,0±2,0* |
12,7±0,26 |
|
ТВ, сек. |
18,2±0,9* |
15,2±0,7* |
13,6±0,29 |
|
ЭВ, сек. |
27,3±1,2* |
30,0±3,4* |
24,0±0,66 |
|
РФМК, мкг/мл |
65,0±8,0* |
210±13,9* |
38,7±0,5 |
|
Фибриноген, г/л |
3,4±0,3 |
3,5±0,4 |
3,0±0,1 |
|
Антитромбин III, % |
95,8±18,7 |
79,7±14,1* |
116,3±4,1 |
|
НО |
0,96±0,1 |
0,61±0,1* |
0,9±0,01 |
|
XII-ЗЛЭ, мин. |
32,6±4,4* |
31,6±4,2* |
6,2±0,2 |
|
ИРП, % |
58,7±4,8* |
79,4±14,1* |
100,0±0,1 |
|
Плазминоген,% |
56,9±5,8* |
62,0±8,7* |
103,0±0,3 |
Примечание: * - достоверность отличий от показателей в группе сравнения.
В динамике, на фоне терапии, у больных группы 1 отмечается повышение числа тромбоцитов на протоколе I с последующей положительной тенденцией. Показатели АПТВ сменились на гипокоагуляцию, на фоне прироста РФМК в 1,5 раза, по сравнению с исходными показателями. По ПТВ, ЭВ гипокоагуляция усиливалась с максимальной выраженностью на протоколе I. Концентрация фибриногена достоверно снижалась, по сравнению с исходным уровнем, а затем нормализовалась. Эти изменения сопровождались снижением активности АТ III к окончанию протокола II. Исходная депрессия фибринолиза сохранялась на всех этапах химиотерапии в этой группе больных. Динамика показателей гемостаза больных первой группы представлена на рис. 2.
Результаты исследования системы гемостаза у пациентов второй группы представлены на рис. 3.
На фоне лечения у больных группы 2 показатели АПТВ на протоколе I меняются на гипокоагуляцию, уровень РФМК снижается в 2 раза, по сравнению с исходными показателями. В динамике, на протоколе II отмечается незначительное повышение свертывающей активности крови. Замедление свертывания крови по ПТВ, ТВ и ЭВ было зарегистрировано до лечения и в динамике достоверно не изменялось. Гипокоагуляция по ПТВ и ЭВ, свидетельствуют о снижение синтеза факторов протромбинового комплекса, что обусловлено инфильтрацией печени бластными клетками. Также на протоколе I происходит достоверное снижение концентрации фибриногена с последующей нормализацией. Исходно низкая активность АТ III, сочеталась с угнетением фибринолиза не только по внутреннему, но и по внешнему механизмам. Клинически в данной группе больных чаще регистрировались: тромбогеморрагический синдром, инфекционно-токсические и полиорганные поражения - печеночная, легочно-сердечная и почечная недостаточность.
Рис. 2. Показатели гемостаза на фоне химиотерапии у больных группы 1
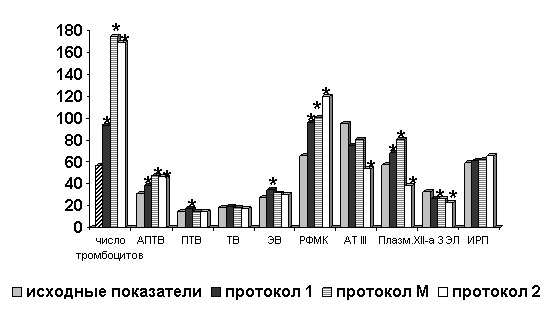
Примечание: * - достоверность отличий от исходных показателей.
Рис. 3. Показатели гемостаза на фоне химиотерапии у больных группы 2
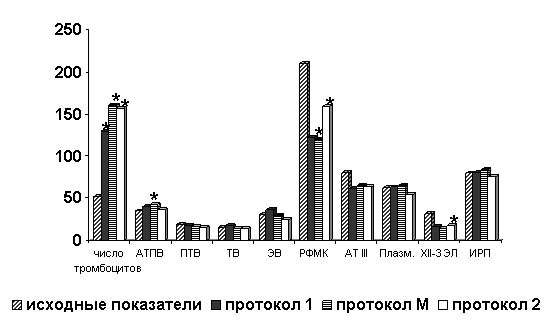
Примечание: * - достоверность отличий от исходных показателей.
Выводы
Таким образом, у детей с ОЛЛ развиваются сложные нетипичные нарушения в системе гемостаза в дебюте заболевания и усугубляются на фоне проведения химиотерапии. Установлена различная степень нарушений свертывающей активности крови, от умеренного до выраженного ее повышения, а у отдельных больных - развитие ДВС-синдрома. В связи с этим диагностика нарушений системы гемостаза у детей с ОЛЛ необходима до программной химиотерапии и в динамике для своевременной коррекции выявленных нарушений с целью предупреждения тромбогеморрагических осложнений.
СПИСОК ЛИТЕРАТУРЫ:
- Алексеев Н.А., Воронцов И.М. // Лекозы у детей - Л: Медицина - 1988. - С. 248.
- Баркаган З.С., Момот А.П. // Диагностика и контролируемая терапия нарушений гемостаза. М: Ньюдиамед. - 2001.
- Борисович Н.В., Белевцев М.В., Алейникова О.В. // Иммунологическая характеристика первых рецидивов острых лимфобластных лейкозов у детей и оценка эволюции иммунофенотипа бластных клеток в рецидиве. Гематология и трансфузиология . - 2004. - №-2. - С.14.
- Заридзе Д.Г. // Эпидемиология детских лейкозов. Арх.пат. - 1997. - №5. -С.65.
- Румянцева Ю.В., Карачунский А.И. // Оптимизация терапии острого лимфобластного лейкоза у детей в России и Белоруссии: стратегия Москва - Берлин. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2007. - Т.6, №4.-С.13.
- Breiteeld P.P. // Acutae lymphoblastic leukemia. Blood Disease of infancy and Childhood/ed D.R.Miller. - Baltimore- 1990. - p.175.
- Lukens J.N. // Acute lymphoblastic leukemia. Wintrobe´s Clinical Hematology/Eds G.R.Lee et al. - London - 1993. - p.1892.



