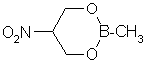
Ранее [1-5] нами было показано, что поверхность потенциальной энергии (ППЭ) молекул 1,3,2-диоксаборинанов содержит один или два (для замещенных аналогов) минимума - конформеры софы (С) - и один максимум - форму 2,5-твист (2,5-Т). Была подробно изучена применимость квантово-химических методов к определению структурных и геометрических характеристик циклических борных эфиров [6,7]. Известно также [1-3,8], что главным минимумом на ППЭ эфиров 2,5-диалкил-1,3.2-диоксаборинанов является экваториальный конформер софы (Се). Однако, в случае 2-алкил-5-нитро-1,3,2-диоксаборинанов согласно данным ЯМР 1Н [8], а также результатам рентгеноструктурных [9] и дипольных измерений [10] реализуется аксиальная форма софы (Са). В то же время полуэмпирические квантово-химические расчеты указывают на относительную выгодность конформера Се [11], что явно противоречит результатам эксперимента.
Для разрешения выявленного противоречия нами с помощью неэмпирических приближений RHF//STO-3G, 3-21G, 6-31G(d) и 6-31G(d,p) в рамках программного обеспечения HyperChem [12] исследована относительная устойчивость конформеров 2-метил-5-нитро-1,3,2-диоксаборинана.
В первую очередь c помощью метода RHF//STO-3G была изучена стабильность различных ротамеров внутреннего вращения нитрогруппы как для аксиальной, так и для экваториальной форм. В обоих случаях были выявлены два ротамера.
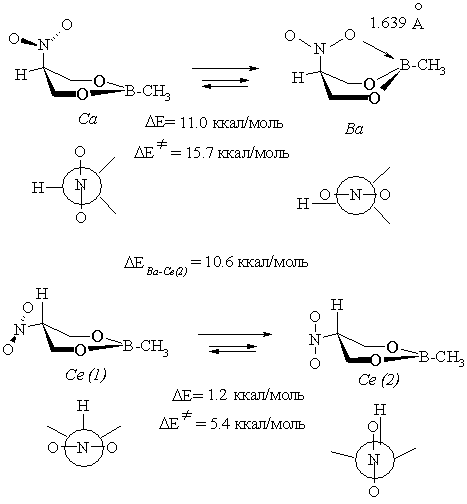
Нетрудно видеть, что в случае аксиального конформера биссектральный ротамер Ва заметно стабильнее ортогональной формы Са. Данные рентгеноструктурных измерений циклического фенилборного эфира бис(оксиалкил)нитрона подтверждают возможность существования такой структуры с экспериментально установленной длинной координационной связи О→В 1.604 Å [13], весьма близкой к расчетному значению этой величины (1.639 Å).
Однако при использовании приближений 6-31G(d) и 6-31G(d,p) ротамер Ва не реализуется; в этом случае помимо конформера Са ППЭ содержит форму полукресла ПКа. В рамках метода 3-21G реализуется только форма ПКа.
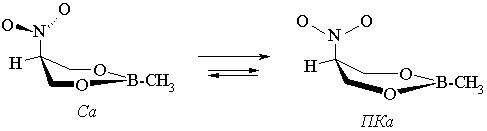
Результаты расчетов относительной стабильности аксиальной и экваториальной форм исследуемого соединения в виде смеси ротамеров представлены в таблице.
Таблица 1. Относительная устойчивость конформеров 2-метил-5-нитро-1,3,2-диоксаборинана
|
Методы расчета |
∆Е (ккал/моль)* |
|
|
Са-Се(2) |
Ва-Се(2) либо ПКа-Се(2) |
|
|
STO-3G 3-21G 6-31G(d) 6-31G(d,p) |
-0.7 - -0.5 -2.1 |
10.6 1.8 0.3 -1.3 |
*) Отрицательные значения свидетельствуют о большей выгодности экваториальной формы
Таким образом, учет существования ротамеров показывает, что в рамках большинства использованных расчетных приближений аксиальная форма более выгодна, чем экваториальная за счет стабилизирующих внутримолекулярных взаимодействий в гетероатомной части кольца, что свидетельствует в пользу смещения конформационного равновесия в сторону аксиального конформера.
СПИСОК ЛИТЕРАТУРЫ:
- Грень А.И., Кузнецов В.В. Химия циклических эфиров борных кислот. Киев: Наукова думка, 1988. - 160 с.
- Кузнецов В.В. Синтез, конформационный анализ и химические превращения циклических борных эфиров диолов и аминоспиртов. Дис. докт. хим. наук, Уфа, 2002.
- Кузнецов В.В. В кн. Успехи органического катализа и химии гетероциклов. М.: Химия, 2006. - С.336-355.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В. // Современные наукоемкие технологии - 2006. - №2. - С. 72-74.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В. // Башкир. хим. журн. 2004. - Т.11, №1. - С.79-80.
- Кузнецов В.В. // Журн. структ. химии. - 2001. - Т.42, №3. - С.591-597.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В. // Современные наукоемкие технологии - 2006. - №2. - С. 71-72.
- Кузнецов В.В., Захаров К.С., Петровский И.В., Грень А.И. // Химия гетероцикл. соединений. - 1990. - №8. - С.1107-1109.
- Kliegel W., Preu L., Rettig S.J., Trotter J. // Can. J. Chem. - 1986. - V.64, №9. - P.1855-1858.
- Urbański T. // J. Sci. and Ind. Res. - 1974. - V.33, N 3. - P.124-130.
- Кузнецов В.В., Бочкор С.А. // Химия гетероцикл. соединений. - 1999. - №8. - 1065-1072.
- HyperChem 5.02. Trial version. http://www.hyper.com/.
- Kliegel W., Preu L., Rettig S.J., Trotter J. // Can. J. Chem. - 1985. - V.63, №2. - P.509-515.



