2 (RS)3B + 3 R1C(O)R2 → B2O3 + 3 R1R2C(SR)2
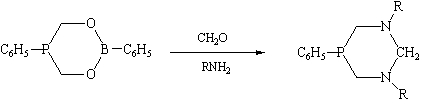
2,5-Дифенил-2-бора-1,3,5-диоксафосфоринан в присутствии алифатических аминов вступает в реакцию с параформом с образованием 1,3,5-диазафосфоринанов [2]:
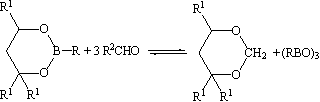
В работе [3] на примере борных эфиров углеводов показана возможность аналогичной реакции с ацетоном; при этом процесс идет селективно и затрагивает только пятичленные циклы.
Ранее [4-6] нами было установлено, что замещенные 1,3,2-диоксаборинаны при реакции с альдегидами превращаются в соответствующие 1,3-диоксаны.
Целью настоящего исследования является изучение взаимодействия пяти- и шестичленных циклических борных эфиров с альдегидами и кетонами.
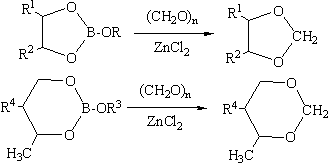
Реакция 1,3-диокса-2-борациклоалканов с альдегидами приводит к соответствующим 1,3-диоксациклоалканам.
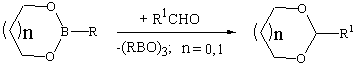
Процесс идет в присутствии каталитических количеств ZnCl2. Выходы легкокипящих 1,3-диоксоланов и 1,3-диоксанов, выделенных при взаимодействии 2-алкокси- и 2-алкилзамещенных циклических борных эфиров с параформальдегидом, составляют от 24 до 82 % (табл.1). В случае высококипящих продуктов мы ограничились аналитическим изучением обсуждаемого взаимодействия; при этом рассматривалось соотношение исходного и конечного соединений (ГЖХ) через 30 мин нагрева при 140 0С в присутствии каталитических количеств ZnCl2 с учетом калибровочных коэффициентов, установленных по методике [7] (табл.2).
Таблица 1. Выходы 1,3-диоксациклоалканов в реакции циклических борных эфиров с параформальдегидом
|
R |
R1 |
R2 |
R3 |
R4 |
Выход, % |
|
С4Н9 iC5H11 C6H13 C7H15 iC4H9 C7H15 iC4H9 - - |
Н H H H CH3 CH3 CH3 - - |
Н H H H H H CH3 - - |
- - - - - - - iC4H9 C4H9 |
- - - - - - - H CH3 |
77 24 27 31 82 53 30 36 30 |
Таблица 2. Соотношение 1,3.2-диоксаборинанов и 1,3-диоксанов в реакции циклических борных эфиров с альдегидами (ГЖХ)
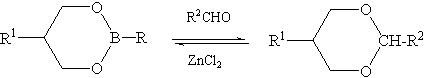
|
R |
R1 |
R2 |
Соотношение 1,3,2-диоксаборинан : 1,3-диоксан |
|
iC3H7 iC3H7 iC4H9 |
C6H5 C6H5 CH3 |
H C2H5 iC3H7 |
70 : 30 91 : 9 65 : 35 |
Необходимо также отметить, что для конфигурационно устойчивых 2,4,5-замещенных 1,3,2-диоксаборинанов, существующих в виде смеси стереоизомеров, скорость реакции транс-изомеров c параформальдегидом выше, чем цис-, благодаря чему образующиеся 1,3-диоксаны отличаются повышенным против ожидаемого содержанием транс-формы (табл.3).
Таблица 3. Соотношение стереоизомеров 1,3,2-диоксаборинанов и 1,3-диоксанов (цис : транс-, ГЖХ)
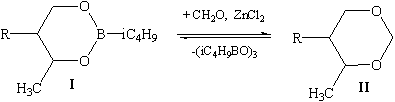
|
R |
Цис : транс |
|||
|
I |
II |
|||
|
До реакции |
В равновесной смеси |
До реакции* |
В равновесной смеси |
|
|
iC3H7 |
77 : 23 35 : 65 |
88 : 12 48 : 52 |
67 : 33 39 : 61 |
62 : 38 33 : 67 |
|
C6H5CH2 |
66 : 34 |
68 : 32 |
66 : 34 |
57 : 43 |
* Соотношение стереоизомеров в образце 1,3-диоксана, полученном прямой реакцией параформальдегида с соответствующим 1,3-диолом.
Степень конверсии циклических борных эфиров I в 1,3-диоксаны II составила в условиях данного эксперимента 20-25%.
В реакцию с кетонами 1,3,2-диоксаборинаны практически не вступают.
ССПИСОК ЛИТЕРАТУРЫ
- Cragg R.H., Husband J.P.N. // Inorg. Nucl. Chem. Lett. - 1970. - V.6, № 9. - P.773-774.
- Арбузов Б.А., Ерастов О.А., Никонов Г.Н. // Изв. АН СССР. Сер. хим. - 1980. - № 4. - С.952-954.
- Griffths C.J., Weigel H. // Carbohydr. Res. - 1980. - V.81, № 1. - P.17-21.
- Кузнецов В.В. Автореф. дисс. канд. хим. наук. - Одесса, 1983. - 23 с.
- Кузнецов В.В., Грень А.И. // Журн. общ. химии. - 1983. - Т.53, вып.6. - С.1432-1433.
- Кузнецов В.В., Брусиловский Ю.Э. ХХ Укр. конф. по орг. химии. Тезисы докл. Одесса, 2004. - С.235.
- Вяхирев Д.А., Шушунова А.Ф. Руководство по газовой хроматографии. - М.: Высшая школа, 1975. - 302 с.



