Известно, что молекулы 2-алкил- (либо 2-алкокси)-5,5-диметил-1,3,2-диоксаборинанов при комнатной температуре пребывают в состоянии быстрой в шкале времен ЯМР инверсии кольца с относительно низким барьером [2]. С целью изучения влияния различных структурных факторов на этот процесс нами в рамках отдельных расчетных методов (пакет HyperChem [3]) исследована поверхность потенциальной энергии (ППЭ) молекул самого 1,3,2-диоксаборинана (1), а также 2- и 2,5,5-замещенных аналогов 2-28. Как и в предыдущих случаях маршрут инверсии и высота барьера активации установлены сканированием отдельных торсионных углов (3-4-5-6 либо 2-3-4-5, ММ+), а также в режиме "transition state" [методы собственных значений (СЗ) или реакционных карт (РК)] (АМ1, ab initio) [1,3-5].
Поверхность потенциальной энергии молекул незамещенного (1) и 2-замещенных (2,3) 1,3,2-диоксаборинанов характеризуется одним минимумом, отвечающим конформеру софы (С), и одним максимумом, соответствующим форме 2,5-твист (2,5-Т) и являющимся переходным состоянием (ПС) на пути инверсии С ↔ С*. Расчетные значения ∆Е≠ этого процесса, полученные с помощью ММ+, не зависят от характера и конформационного объема заместителя у атома бора (Н, ОСН3, iC3H7, табл.). Из-за относительно низкой температуры коалесценции экспериментальная оценка величины ∆G≠ эфира 3 с помощью низкотемпературной спектроскопии ЯМР 1Н позволила установить только верхний ее предел (<9.0 ккал/моль) [4].
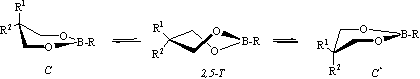
Все исследованные 2,5,5-замещенные борные эфиры (4-28) по конформационному поведению, наглядно отражаемому характером ЯМР 1Н сигнала метиленовых протонов кольца, можно разделить на три группы. Первую составляют вещества с одинаковыми заместителями у атома С5 кольца (эфиры 4-17). Синглетный характер сигнала метиленовых протонов кольца в спектрах ЯМР 1Н при комнатной температуре с полушириной (∆ν), в большинстве случаев не превышающей 0.01-0.03 м.д. (табл.), свидетельствует о быстрой в шкале времен ЯМР инверсии цикла. При понижении температуры образца происходит уширение отмеченного сигнала (рис. a), однако из-за низкой температуры коалесценции определить экспериментальную величину свободной энергии активации ранее удалось только для эфиров 4 и 5 [2], а также для соединения 10.
Установленные с помощью ММ+ расчетные значения ∆Е≠ процесса инверсии, идущего, как и в предыдущих случаях, через ПС 2,5-Т, близки к экспериментальным ∆G≠, известным для отдельных соединений. Они возрастают с увеличением массы заместителей и уменьшаются для алкокси- и фенокси-, а также аллил-замещенных аналогов (эфиры 8 и 9, 11 и 12, 8 и 15).
Ко второй группе относятся эфиры (18-23) с различными заместителями у атома С5; характер сигнала метиленовых протонов кольца при комнатной температуре указывает на инверсию между двумя невырожденными по энергии формами софы. Величина ∆ν составляет в этом случае 0,09-0,12 м.д.(293 К) и, как и для соединений первой группы, заметно возрастает при понижении температуры образца. (рис. б). Значения ∆Е между двумя конформерами, отвечающими минимумам энергии на ППЭ, укладываются в интервал 0.1-1.4 ккал/моль. Необходимо отметить, что для молекул 5-метил-5-метоксианалога 20 главному минимуму согласно ММ+ отвечает конформер с аксиальной метокси-группой; это хорошо согласуется с данными ЯМР 1Н циклических борных эфиров, содержащих алкокси- либо арилокси-заместители у атома С5. По данным расчетов аксиальная карбэтоксильная группа выгоднее, нежели ацетильная (эфир 18); во всех случая более устойчивому конформеру отвечает экваториальная ориентация аллильного заместителя (эфиры 19, 22, 23). Значения расчетных активационных барьеров для молекул обсуждаемых соединений растут с увеличением массы заместителей. Нетрудно видеть, что степень смещения конформационного равновесия определяется в основном природой заместителей (конформационный объем, электронные свойства).
В случае эфиров 24-28 (соединения третьей группы) отмеченные различия становятся достаточными для преимущественного смещения равновесия в сторону одной из форм: сигналы метиленовых протонов кольца проявляются как обычная АВ-система (рис. в). Величина ∆ν составляет 0,20-0.47 м.д. и мало зависит от температуры. Для такого равновесия как и в случае соединений второй группы характерна относительная выгодность конформеров с аксиальной ориентацией электроноакцепторных заместителей, в частности, алкокси- (20, 24, 27), фенокси- (26), фенил- (25), карбэтокси- (18), нитро-(АМ1, 28).
Таблица 1. Параметры конформационного равновесия эфиров 1-28 (ккал/моль)
|
№ |
R |
R1 |
R2 |
Метод |
Поиск ПС |
∆Е≠(эксп.∆G≠) |
∆E |
Миним. Е |
∆ν (м.д.) (Т,К) |
|
1
2
3 4 5
0 7 8 9 10
11 12 13
14 15 16 17 18 19 20 21 22 23
24 25 26 27 28 |
Н
ОСН3
iC3H7 ОСН3 С2Н5
iC3H7 ОН iC3H7 iC3H7 iC3H7
iC3H7 iC3H7 iC3H7
iC3H7 iC3H7 C2H5 iC4H9 iC3H7 iC3H7 iC3H7 iC3H7 iC3H7 iC3H7
iC3H7 iC3H7 iC3H7 iC3H7 iC3H7 |
Н
Н
H СН3 СН3
СН3 СН3 С2Н5 С3Н5 С6Н5СН2
С6Н5 ОС6Н5 СООСН3
CO2C2Н5 О-iC3H7 COOCH3 COOCH3 CO2C2Н5 С3Н5 СН3 СН3 СН3 iC3H7
СН3 СН3 СН3 С2Н5 NO2 |
Н
Н
H СН3 СН3
СН3 СН3 С2Н5 С3Н5 С6Н5СН2
С6Н5 ОС6Н5 СООСН3
CO2C2Н5 О-iC3H7 COOCH3 COOCH3 СОСН3 С6Н5СН2 ОСН3 iC3H7 С3Н5 С3Н5
СН2ОСН3 С6Н5 С6Н5О СН2ОСН3 Br |
ММ+
АМ1 STO-3G 3-21G 6-31G 6-31G* 6-31G** ММ+
АМ1 MM+ ММ+ ММ+ STO-3G 3-21G 6-31G ММ+ ММ+ ММ+ ММ+ ММ+
ММ+ ММ+ ММ+
ММ+ ММ+ MM+ ММ+ ММ+ ММ+ ММ+ ММ+ ММ+ ММ+
ММ+ ММ+ ММ+ ММ+ MM+ AM1 |
2-3-4-5 3-4-5-6 СЗ, РК РК РК РК РК РК 2-3-4-5 3-4-5-6 РК 3-4-5-6 3-4-5-6 3-4-5-6 РК РК РК 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 2-3-4-5 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6
3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6
3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 3-4-5-6 |
7.3 6.9 3.4 6.7 8.1 7.8 7.7 7.6 7.3 6.9 2.8 6.9 (<9.0)* 7.7 (7.0)** 7.7 (8.0)** 7.4 9.1 8.3 7.8 7.7 9.1 7.7 9.8 (9.7)* 9.5 9.3 8.8 9.5
10.0 8.2 8.3 9.8 10.4 8.8 8.8 8.7 7.7 9.7
7.9 9.0 9.0 7.9 9.0 4.5 |
0
0
0 0 0
0 0 0 0 0
0 0 0
0 0 0 0 0.5 0.2 1.4 0.1 0.3 0.4
0.1 1.4 1.9 0.3 2.2 2.0 |
-
-
- - -
- - - - -
- - -
- - - - СОСН3 (е) С3Н5 (е) СН3 (е) iC3H7 (е) С3Н5 (е) С3Н5 (е)
СН3 (е) СН3 (е) СН3 (е) С2Н5 (е) NO2 (e) Br (e) |
-
-
0.01 (293) -
0.01(293) 0.02(293) 0.03(293) 0.07(293) 0.02(293) 0.14(173) 0.01(293) 0.01(293) 0.03(293) 0.14 (173) 0.01(293) 0.01(293) 0.02(293) 0.02(293) 0.11(293) 0.09(293) 0.09(293) 0.12(293) 0.09(293) 0.10(293) 0.13(203) 0.20(293) 0.21(293) 0.25(293) 0.20(293) 0.22(193) 0.47(293) 0.48(213) |
* По данным настоящего исследования.
** По данным работы [2]
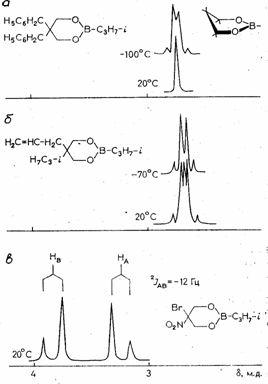
Рисунок 1. Спектры ЯМР 1Н метиленовых протонов кольца эфиров 10 (а), 27(б) и 28 (в).
В то же время аллильный заместитель (эфиры 19, 22, 23) ориентирован преимущественно экваториально. При этом величины ∆Е≠ близки к рассчитанным для остальных 5,5-дизамещенных 1,3,2-диоксаборинанов. Как и в предыдущих случаях обращает внимание относительно низкое значение активационного барьера, полученного с помощью метода АМ1 (эфир 28).
Полученные результаты дают основание полагать, что характер ППЭ замещенных циклических борных эфиров в отличие от однотипно замещенных 1,3-диоксанов [6] содержит только один максимум и отличается более низкими значениями барьеров активации.
СПИСОК ЛИТЕРАТУРЫ
- Кузнецов В.В. Диссертация на соиск. уч. степени докт. хим. наук. Уфа, 2002. 325 с.
- Carton D., Pontier A., Ponet M., Soulie J., Cadiot P. // Tetrahedron Lett., 1975. - № 28. - P.2333.
- HyperChem 5.02. Trial version. http://www.hyper.com/.
- Кузнецов В.В., Новиков А.Н. // Химия гетероциклических соединений. 2003. №2. С.295-298.
- Валиахметова О.Ю., Бочкор С.А., Кузнецов В.В // Башкирский химический журнал. 2004. Т.11. №1. С.79-80.
- Кузнецов В.В., Курамшина А.Е., Файзуллин А.А., Бочкор С.А. // Сб. материалов ИВТН-2003. С.18.



