Настоящая работа посвящена рассмотрению вопросов ионного равновесия в азотнокислых растворах для двухзарядных ионов металлов. Ионы металлов с различными комплексообразующими лигандами образуют комплексы разного состава, структуры и устойчивости. Для рассмотрения механизма сорбции на катионитах важно знать, какого типа комплекс образуется в растворе в тех или иных условиях и насколько этот комплекс будет устойчивым.
Для большинства двухвалентных элементов характерно образование довольно устойчивых комплексных соединений с нитрат-ионами. Константы устойчивости азотнокислых комплексных соединений по данным [1, 2] представлены в табл. 1.
Таблица 1. Константы устойчивости нитратных комплексов двухвалентных элементов
|
Элемент |
Значения lg Kуст для комплекса |
|||
|
MeNO3+ |
Me(NO3)2 |
Me(NO3)-3 |
MeOH+ |
|
|
Барий |
0,92 |
- |
- |
6 |
|
Медь |
- |
- |
-3,33 |
0,7 |
В водных растворах свободные катионы металлов практически не существуют вследствие сильной гидратации. Растворы солей данных ионов имеют кислую реакцию, что объясняется гидролизом этих металлов. Присутствие нитрат ионов способствует замещению гидроксильных групп в координационной сфере гидратированных форм на нитрат-ионы с образованием нитратных комплексных ионов. На ионное равновесие влияет рН и концентрация азотной кислоты.
Схема ионного равновесия включает следующие процессы:
1. Процесс гидратации.
![]() (1)
(1)
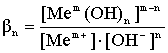
В большинстве случаев, когда в растворе находятся ионы металлов с зарядом >2, процесс осложнен образованием полиядерных комплексов.
![]()
Доля полиядерных комплексов повышается при увеличении концентрации ионов металла, времени гидролиза и температуры.
2. Процесс замещения гидроксид ионов во внутренней координационной сфере на нитрат-ион с образованием смешанных гидроксонитратных комплексных ионов:
![]()
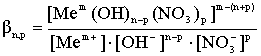 ; (2)
; (2)
3. Процесс дальнейшего замещения гидроксид ионов с образованием чисто нитратных ионов.
![]()
4. Процесс образования более высококоординированных нитратных комплексных ионов.
![]()
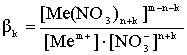 , (3)
, (3)
где βk - константа устойчивости соответствующего комплексного иона.
Исходя из выражений (1) - (3) концентрации комплексных ионов металлов в растворе будут следующими:
![]() ; (4)
; (4)
![]() (5)
(5)
![]() . (6)
. (6)
Содержание того или иного комплексного иона в растворе (доля) зависит от нескольких факторов: рН, концентрации нитрат-ионов, констант устойчивости образующихся ионов. При заданных концентрациях гидроксид- и нитрат-ионов можно рассчитать мольную долю каждого конкретного иона ![]() . В растворе будут находиться в равновесии концентрации всех форм металла: несвязанного в комплекс металла
. В растворе будут находиться в равновесии концентрации всех форм металла: несвязанного в комплекс металла ![]() , гидролизованных ионов, смешанных гидроксо-нитратных и нитратных ионов металла:
, гидролизованных ионов, смешанных гидроксо-нитратных и нитратных ионов металла:
![]() ; (7)
; (7)
![]() ; (8)
; (8)
![]() , (9)
, (9)
Таким образом, общая концентрация металла в растворе (CMe ) будет выражается уравнением:
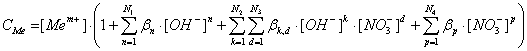 (10)
(10)
Равновесие в растворе будет определяться в соответствии с мольными долями существующих комплексных ионов:
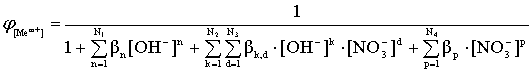 ; (11)
; (11)
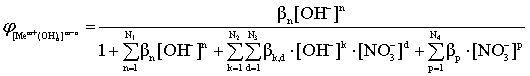 ; (12)
; (12)
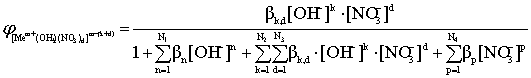 (13)
(13)
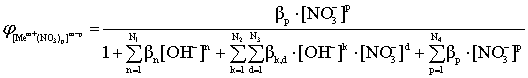 ; (14)
; (14)
Общая концентрация лиганда (![]() ) для систем, содержащих HNO3, будет определяться соответственно уравнением:
) для систем, содержащих HNO3, будет определяться соответственно уравнением:
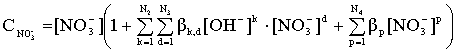 (15)
(15)
Из приведенных уравнений следует, что мольные доли свободного металла и различных комплексов при заданных общих константах устойчивости зависят только от концентрации свободного лиганда. При известных константах устойчивости эти уравнения позволяют рассчитать процентное соотношение различных соединений (иона металла и комплексов) в растворе, содержащем любые концентрации комплексообразующего реагента.
Распределение ионов рассчитывали с использованием констант устойчивости нитратных и гидроксокомплексов, приведенных в табл. 1. Диаграммы распределения форм ионов металлов от логарифма равновесной концентрации нитратных - и гидроксид- ионов представлены на рис. 1.
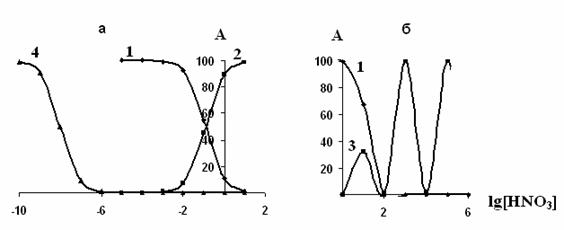
Рис. 1. Диаграмма равновесного распределения нитратных комплексных ионов и гидроксокомплексов бария (а) и меди (б) в растворах азотной кислоты.
![]()
Распределение ионов двухвалентных ионов металлов в растворах ![]() , рассчитанное по приведенным зависимостям с использованием ЭВМ, представлены в табл. 2.
, рассчитанное по приведенным зависимостям с использованием ЭВМ, представлены в табл. 2.
Таблица 2. Распределение ионов двухвалентных металлов в в растворах
|
Ион |
Доля ионов (%), при концентрации HNO3, моль/дм3 |
||||
|
|
0 |
0,1 |
0,3 |
0,5 |
1,0 |
|
Ba 2+ |
99,99 |
54.59 |
28.61 |
19,38 |
10.73 |
|
BaNO3+ |
0 |
45.41 |
71.39 |
80,62 |
89.27 |
|
BaOH+ |
0 |
0 |
0 |
0 |
0 |
|
Cu 2+ |
1 |
1 |
99.99 |
99.98 |
99.95 |
|
CuNO3+ |
0,05 |
8,89 |
20,97 |
28,29 |
37,81 |
|
Cu(NO3)3- |
0 |
0 |
0.001 |
0.006 |
0.047 |
|
CuOH+ |
0 |
0 |
0 |
0 |
0 |
Как видно из полученных результатов двухзарядные ионы металлов в растворе находятся в виде свободных катионов и мононитратных комплексов. С увеличением концентрации HNO3 в растворе доля ионов Me 2+ постепенно уменьшается, а доля нитратных комплексов повышается.
У катионов меди в растворе присутствуют как положительно, так и отрицательно заряженные комплексные ионы. С увеличением концентрации азотной кислоты в растворе увеличивается доля отрицательно заряженных ионов.
Ионное состояние металлов меди и бария в растворе позволяет определить условия сорбции того или иного элемента катионитом, а также предположить состав комплексных ионов в фазе последнего.
Выводы
- На основании имеющихся литературных данных рассмотрены основные свойства простых и комплексных нитратных соединений элементов и их поведение в водных растворах. Предложены зависимости доли существующих ионов (φ) от ряда факторов.
- С использованием зависимостей φ и значений равновесных концентраций рассчитаны диаграммы равновесного распределения комплексных ионов металлов.
СПИСОК ЛИТЕРАТУРЫ:
- Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480с.
- Ракитская Т.Л., Редько Т.Д., Волкова В.Я. // Вестник ОНУ, 2008. Т. 9, Вып. 3, с 98-106.
Библиографическая ссылка
Пимнева Л.А., Нестерова Е.Л. ИОННЫЕ РАВНОВЕСИЯ БАРИЯ И МЕДИ В АЗОТНОКИСЛЫХ РАСТВОРАХ // Современные наукоемкие технологии. 2008. № 12. С. 14-18;URL: https://top-technologies.ru/ru/article/view?id=24331 (дата обращения: 17.11.2025).



