Введение
В течение последнего десятилетия отечественная система образования активно развивается благодаря наполнению информационной среды вузов и школ соответствующим оборудованием и учебными ресурсами. Новейшие информационные технологии, которые помогают студентам в учебном процессе и научно-исследовательской работе, успешно интегрируются в их будущую профессиональную деятельность. В условиях такой цифровой трансформации значительно повысились требования к подготовке педагогических кадров для системы образования. Будущие педагоги должны уметь применять в образовательных организациях электронную образовательную среду, включающую различные цифровые сервисы для обучающихся и преподавателей [1]. Для этого меняются подходы к процессу обучения, в арсенале средств педагогов появляются цифровые инструменты [2; 3]. Кроме того, модернизируется учебно-производственная база. Так, в рамках реализации программы Министерства просвещения РФ «Учитель будущего поколения России» в педагогических вузах были созданы технопарки универсальных педагогических компетенций, оснащенные новым современным оборудованием, в частности цифровыми лабораториями.
Цифровая лаборатория – это естественно-научная лаборатория, которая позволяет организовать химический эксперимент на принципиально новом уровне, перейти к элементам научного исследования – от исключительно качественной оценки наблюдаемых явлений к анализу количественных характеристик [4]. Цифровые лаборатории имеют ряд преимуществ перед традиционной формой проведения химического эксперимента [5]:
– обеспечивают объективное и наглядное представление результатов эксперимента в виде графиков, диаграмм и таблиц;
– предоставляют возможность хранения компьютерной обработки результатов эксперимента, данных измерений;
– предоставляют возможность сопоставить данные, полученные в ходе различных экспериментов;
– сокращают время эксперимента;
– позволяют индивидуализировать обучение.
Технопарк Омского государственного педагогического университета оснащён несколькими цифровыми лабораториями по химии, среди которых цифровая лаборатория по кинетике (учебно-лабораторный комплекс «Физическая и коллоидная химия» УНИТЕХ). В работах [6; 7] рассмотрено применение цифровых лабораторий при обучении в вузе общехимическим дисциплинам, а также их роль в профессиональной подготовке будущих учителей химии. Однако также представляет интерес сравнить использование этого нового вида оборудования с традиционным при обучении фундаментальным химическим дисциплинам, например физической и коллоидной химии.
Цель исследования: показать преимущества использования цифровой лаборатории (на примере учебно-лабораторного комплекса «Физическая и коллоидная химия» УНИТЕХ) по сравнению с традиционным оборудованием при обучении физической и коллоидной химии в педагогическом университете (направление «Педагогическое образование», профиль «Биология и химия»).
Материал и методы исследования
В ходе исследования предстояло сравнить использование разных видов оборудования при выполнении студентами практических работ по физической и коллоидной химии. Для этого были использованы теоретические и эмпирические методы, такие как анализ, синтез, обобщение, изучение мнений студентов.
Дисциплина «Физическая и коллоидная химия» включена в обязательную часть структуры основной профессиональной образовательной программы подготовки бакалавра по направлению «44.03.05 Педагогическое образование» (с двумя профилями подготовки), направленность (профиль) «Биология и химия». На изучение дисциплины по учебному плану отводится 216 часов. Курс физической и коллоидной химии состоит из разделов: химическая термодинамика, химическая кинетика, коллоидная химия. Термодинамический блок содержит работы по термохимии, химическому равновесию (на примере наиболее доступных ионных систем) и электрохимической термодинамике. В этом блоке студенты знакомятся с основами потенциометрии, рН-метрии. В кинетический блок включены работы по установлению порядков реакций, констант скоростей, энергий активации, времени полупревращения. При выполнении работ этого блока студенты осваивают газометрический и фотоколориметрический методы, а также знакомятся с гальваностатическим методом получения защитных покрытий, иллюстрирующим практическое использование закономерностей электрохимической кинетики. В блоке коллоидной химии студенты знакомятся с адсорбцией, свойствами коллоидных и микрогетерогенных систем.
Многие практические работы курса «Физическая и коллоидная химия» могут выполняться как с применением традиционного лабораторного оборудования (рН-метр/иономер, фотоколориметр КФК-3, кондуктометр и др.), так и с применением датчиков цифровой лаборатории учебно-лабораторного комплекса «Физическая и коллоидная химия» УНИТЕХ. Программа практических работ такой лаборатории соответствует современным требованиям ФГОС.
В качестве примера сравним методики, оборудование и результаты одной из работ, которая предлагается студентам для изучения раздела химической кинетики, – «Разложение триоксалата марганца фотоколориметрическим методом».
Цель практической работы: рассчитать константу скорости и время полупревращения реакции разложения триоксалата марганца.
В результате разложения комплексного иона триоксалата марганца [Mn(C2O4)3]3– образуются ионы Mn2+, оксалат-ионы и углекислый газ:
[Mn(C2O4)3]3– → Mn2+ + 2,5C2O42– + CO2↑
Данную работу можно проводить традиционным способом с помощью фотоколориметра КФK-3 и с применением фотоколориметра цифровой лаборатории учебно-лабораторного комплекса «Физическая и коллоидная химия» УНИТЕХ. Методики проведения практической работы приведены в таблице 1.
Таблица 1
Сравнение методик проведения практической работы с применением традиционного оборудования и цифровой лаборатории
|
Традиционный способ [8; 9] |
С применением датчиков цифровой лаборатории [10] |
|
|
Оборудование |
||
|
Фотоколориметр КФK-3, набор кювет, секундомер, термометр, два химических стакана на 50 мл, пипетки на 2, 5, 10 мл |
Учебно-лабораторный модуль «КИНЕТИКА», фотоколориметр 470 нм, сетевой кабель, магнитная мешалка, извлекатель магнитной мешалки, ручной дозатор переменного объема, промывалка с дистиллированной водой, стаканчик термостойкий 150 мл |
|
|
Реактивы |
||
|
0, 1 M KMnO4, 0,1 M MnSO4, 0,1 M H2C2O4 |
0,1 M KMnO4, 0,1 M MnSO4, 0,1 M H2C2O4 |
|
|
Методика эксперимента |
||
|
1. Ознакомьтесь с методикой работы на фотоколориметре. 2. Включите фотоколориметр и установите синий светофильтр (длина волны 470 нм). 3. Приготовьте раствор триоксалата марганца: смешайте 1 мл раствора MnSO4 и 7 мл раствора H2C2O4. Прибавьте 2 мл раствора KMnO4. Бесцветная смесь становится окрашенной. 4. Поместите полученный коричневый раствор в кювету толщиной 10 мм. Примите за начало опыта первое измерение оптической плотности Dо (в этот момент включите секундомер). Оптическую плотность D измеряйте через каждые 2 минуты. Общее количество точек не менее 12. 5. Результаты занесите в таблицу «Зависимость оптической плотности раствора триоксалата марганца от времени (Т=___ К, Do=___)». 6. Постройте график зависимости логарифма оптической плотности от времени. Для построения графика воспользуйтесь методом наименьших квадратов |
1. Тщательно промытый стаканчик на 150 мл с магнитной мешалкой установите в термостате. Термостат не используют, поскольку эксперимент проводят при комнатной температуре. 2. Пипеткой отмерьте 10 мл раствора MnSO4 и 70 мл раствора H2C2O4. Растворы перемешайте в стаканчике с помощью магнитной мешалки. 3. Фотоколориметр и термодатчик закрепите в лапках штативов по центру стакана так, чтобы они не касались его дна. Далее датчики соедините с помощью соединительных проводов с учебно-лабораторным модулем. 4. Выберите тип эксперимента КИНЕТИКА. На вкладке УСТРОЙСТВА выберите датчик ФОТОКОЛОРИМЕТР и ТЕРМОДАТЧИК. На вкладке ИЗМЕРЕНИЕ задайте интервал измерений 2 минуты, а общее количество точек 12. 5. В стаканчик добавьте 20 мл раствора KMnO4. Сразу же после добавления нажмите кнопку ЗАПИСЬ. По завершении записи данных можно посмотреть результаты измерений во вкладке РЕЗУЛЬТАТЫ |
|
Результаты исследования и их обсуждение
На основании значений оптической плотности (Dt), полученных с помощью фотоколориметра КФК-3 и фотоколориметра цифровой лаборатории, был рассчитан логарифм оптической плотности (lgDt).
Графическим методом определен порядок исследуемой реакции. Для этого построены графики в координатах lgDt = f(t). Экспериментальные данные дали прямолинейную зависимость для функции, описывающей реакции первого порядка (1) (рис. 1).
Расчетным и графическим способами рассчитана константа скорости реакции. Расчётный способ: константу скорости реакции рассчитывают по уравнению первого порядка (1) для каждого момента времени, с последующим усреднением.
Kt = (2.3 / t) ∙ lg(D0 / Dt), (1)
где D0 – оптическая плотность в начальный момент времени;
Dt – оптическая плотность вещества в разные моменты времени,
t – время, мин.
Графический способ: константу скорости реакции определяют по тангенсу наклона прямой, построенной в координатах lg(D0 / Dt ) = f(t), что наглядно представлено на рисунке 2.
Время полупревращения рассчитано по формуле (2) и из графика.
t0,5 = (ln2) / K, (2)
где t0,5 – время полупревращения, K – константа скорости.
Полученные расчетные результаты кинетических параметров представлены в таблице 2.
Таким образом, проведенное исследование показало, что экспериментальные результаты, полученные с помощью разных приборов, совпадают, поэтому можно заменять общепринятое оборудование датчиками цифровой лаборатории.
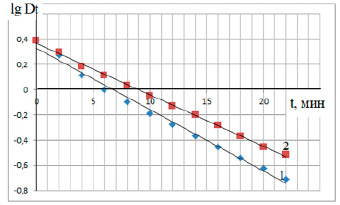
Рис. 1. График зависимости lgDt = f(t): (1) – результаты, полученные на фотоколориметре КФК-3; (2) – результаты, полученные с помощью фотоколориметра учебно-лабораторного комплекса «Физическая и коллоидная химия» УНИТЕХ
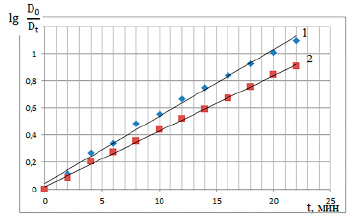
Рис. 2. График зависимости lg(D0 / Dt) = f(t): (1) – результаты, полученные на фотоколориметре КФК-3; (2) – результаты, полученные с помощью фотоколориметра учебно-лабораторного комплекса «Физическая и коллоидная химия» УНИТЕХ
Таблица 2
Сводка расчётных кинетических параметров
|
Кинетический параметр |
Результаты, полученные с помощью фотоколориметра КФK-3 |
Результаты, полученные с помощью фотоколориметра учебно-лабораторного комплекса «Физическая и коллоидная химия» УНИТЕХ |
|
К (расч.) |
0,123 |
0,097 |
|
К (граф.) |
0,113 |
0,113 |
|
t0,5 (расч.) |
5,63 |
7,14 |
|
t0,5 (граф.) |
6,13 |
6,13 |
Фотоколориметр КФК-3 традиционно используется при выполнении фотометрического анализа в учебном процессе. Он позволяет работать при разной длине волны, обладает широким диапазоном измерений, точен. Однако в настоящее время КФК-3 – дорогостоящий прибор, и не во всех учебных заведениях есть возможность его приобрести. Для работы на этом приборе от студентов требуются специальные умения: настройка, подбор длины волны, подготовка кювет, пробоотбор. При наличии возможности подключения КФК-3 к персональному компьютеру с целью автоматизации процесса обработки полученных результатов необходима установка специального программного обеспечения. Все это свидетельствует о возможности его замены цифровой лабораторией. Цифровая лаборатория обладает, по мнению авторов, следующими преимуществами. Не требуется настройка датчика фотоколориметра. Не требуется пробоотбор, датчик погружается непосредственно в пробирку, что повышает точность измерений и упрощает его использование. Также в состав цифровой лаборатории входит термостат, что позволяет проводить химический эксперимент при определенной температуре. Полученные данные сохраняются во вкладке ГРАФИКИ, их можно перенести в электронную таблицу Exсel, что сокращает обработку результатов. Минусом фотоколориметра цифровой лаборатории является то, что он рассчитан только на определённую длину волны, т. е. для каждой работы необходимо приобретать «свой» датчик.
Несмотря на это ограничение, считаем возможным использование цифровой лаборатории при обучении фундаментальным химическим дисциплинам. Тем более, что умение работать с цифровыми датчиками необходимо студентам для их будущей профессиональной деятельности со школьниками. Опрос студентов показал, что им нравится работать с цифровой лабораторией. Помимо вышеуказанных преимуществ, они отметили, что более уверены при использовании цифровых датчиков по сравнению с традиционным оборудованием, поскольку уже имеют опыт их использования, приобретенный при изучении методических дисциплин, а также при организации проектной и исследовательской деятельности школьников.
Заключение
Фотометрический метод востребован в курсе физической и коллоидной химии (при проведении кинетических измерений, при изучении оптических свойств дисперсных систем и др.). Сравнительный анализ использования разных видов оборудования показал, что измерения можно проводить традиционным способом на фотоколориметре КФК-3 и с использованием цифровой лаборатории. При этом цифровая лаборатория обладает рядом преимуществ (простота использования, сокращение времени проведения эксперимента, наглядность представления полученных результатов и др.), что позволяет повысить интерес студентов и результативность обучения в целом.
Библиографическая ссылка
Герасимова И.В., Скворцова И.В. ИСПОЛЬЗОВАНИЕ ЦИФРОВОЙ ЛАБОРАТОРИИ В КУРСЕ ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ // Современные наукоемкие технологии. 2024. № 11. С. 163-167;URL: https://top-technologies.ru/ru/article/view?id=40224 (дата обращения: 17.12.2025).
DOI: https://doi.org/10.17513/snt.40224



