Оптическая когерентная томография (ОКТ) эффективно используется для построения высокоточных структурных изображений биологических объектов в реальном масштабе времени. Данные работы относятся в основном к медико-биологическим исследованиям, так как точные многомерные изображения биологических тканей способны не только дать исчерпывающую информацию о морфологических особенностях (структурные изображения) живого организма, но и обеспечить понимание динамических процессов (функциональные изображения), происходящих на клеточном уровне. Такой точности и скорости построения многомерных изображений сетчатки глаза, слоёв кожи, кровеносных сосудов, слизистых оболочек при проведении исследований in vivo сейчас не способен дать ни один другой метод диагностики, поэтому именно ОКТ заняла особое место в биологических исследованиях живых организмов. Для сравнения, диффузионная оптическая томография (ДОТ) основана на реконструкции трехмерного распределения физических свойств объекта при решении обратной задачи распространения, проникновения оптического излучения со значительным диффузным рассеянием оптического излучения малой длины волны и когерентности в среде, при этом не обеспечивается разрешающая способность от единиц до долей микрона, что важно при выборе методов исследования in vivo (рентгеновской, магнитно-резонансной, ультразвуковой томографии) [1, 2].
Одно из наиболее актуальных направлений развития ОКТ в области биомедицины – это увеличение глубины когерентного зондирования (ГКЗ) и визуализация структуры поверхностных слоев кожи, которая является решающей при ранней диагностике рака кожи. Высокое разрешение ОКТ до микронного масштаба, как правило, недостаточно для прямой визуализации клеточных органелл и исследований субклеточного уровня, поскольку они имеют существенно меньший размер. Тем не менее есть некоторые свидетельства того, что анализ изображений спекл-структур ОКТ позволяет извлечь дополнительную информацию о клетках тканей in vivo [3, 4].
Целью данной работы было выявление закономерных связей между функциональными ОКТ изображениями с помощью анализа изменения интенсивности пикселей отдельных частей изображений.
Для решения поставлено задачи были использованы локальные вариации интенсивности пикселей ОКТ изображений для определения средних изменений свойств рассеивателей в исследуемой части ткани. Соответствующие количественные, метрические методы используются для выявления различий структурных (области кожи) и функциональных (области крови) изображений in vivo. В частности, пространственное изменение интенсивности спеклов и пикселей изображений количественно определяется путем подгонки исходных данных с функцией гамма-распределения, аналогично методам, использованным в исследованиях высокочастотной ультразвуковой характеристики ткани и ОКТ исследованиях [5, 6]. Распределение интенсивности пикселей аппроксимируется гамма-распределением с использованием алгоритма оптимизации наименьших квадратов.
Материалы и методы исследования
Основным объектом исследования были поверхностные слои кожи человека in vivo с подкожными кровеносными сосудами. На рис. 1 представлено ОКТ изображение (B-скан) и вариационная матрица нестандартной ОКТ системы, использующей малоугловое растровое сканирование в плече образца. Исходное изображение – результат сложения 900 А-сканов, ГКЗ увеличена на 25–35 %, размер изображения 2×2 мм. На рисунке отчетливо виден роговой слой эпидермиса, различимы границы структур фасции и кровеносного сосуда. Изображение содержит подкожный кровеносный сосуд диаметром ~1 мм, визуализируемый до глубины 1–1,8 мм.
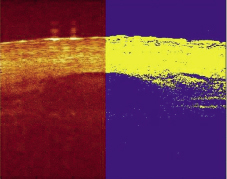
Рис. 1. Структурное ОКТ изображение кожи, сосуда и крови человека in vivo (слева); и обработанная часть – вариационная матрица (справа); размер 2×2 мм
Оптические характеристики ткани и сосудов сильно различаются, а следовательно, им соответствует различная интенсивность пикселей конечного изображения. Для проверки данной гипотезы была построена гистограмма цветов изображения участков кожи и сосудов [7].
Отметим, что исходное изображение имело стандартный канал RGB8, каждый пиксель которого кодируется одним байтом, соответственно, максимальное количество цветов, которые могут быть отображены одновременно – 256 (28).
Для построения гистограммы были выбраны несколько прямоугольных областей одинакового размера, соответствующие участкам кожи и сосуда. В дальнейшем полученные гистограммы были усреднены для минимизации погрешности и нахождения правильной формы закономерности (рис. 2).
Необходимо отметить различия в распределении интенсивностей пикселей соответствующих крови и кожи. Для выявления закономерностей гистограмм, результаты были поставлены в соответствие гамма распределениям (2), являющимся обобщением распределения Xi-квадрат (1) и, соответственно, экспоненциального распределения
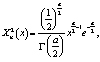 (1)
(1)
где n – число степеней свободы 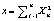 ,
,
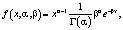 (2)
(2)
где Г – гамма функция Эйлера: 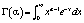 .
.
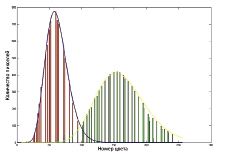
Рис. 2. Гистограмма интенсивности пикселей структурного изображения. Красным цветом показано распределение участков внутри сосуда (крови), зеленым – участков кожи. Синяя и желтая линии – соответствующие гамма-распределения
Гамма-распределение определяется двумя неотрицательными параметрами: α – число степеней свободы (при целом значении степеней свободы гамма-распределение называется распределением Эрланга) и β – коэффициент масштаба, «среднее» распределения, полученное с помощью α/β, использовалось здесь в качестве составной метрики для обнаружения свойств ткани. Как известно, в контексте высокочастотного ультразвука это отношение пропорционально эффективной плотности числа рассеивателей в ткани и может быть связано с изменениями в клетках, влияющими на свойства упругого и квазиупругого рассеяния [8–10].
Полученные распределения показаны (рис. 2) для области кожи и сосуда и отражают четкие различия в распределении интенсивностей пикселей и среднего значения α/β соответствующих графиков гамма-распределения, которое составило, α/β = 2,7·10-4 для области крови и α/β = 7,0·10-4 для кожи. Теснота подгонки соответствует R2 ~ 0,95, демонстрируя хорошее количественное соответствие обработанных данных.
Важной областью исследования является участок структурного изображения (B-скан), который охватывает переход от ткани кожи к области сосуда и крови. Это было получено на основе алгоритма скользящего ящика. В данном подходе прямоугольник, равный по размеру 150×50 пикселей, перемещается сверху вниз изображения. При этом строится гистограмма распределения интенсивностей, полученные результаты представлены на рис. 3.
Из рисунка следует, что переход из области ткани в область сосуда определяется количественно по уменьшению амплитуды и уширению соответствующего пика распределения. Ткани, обладающие наименьшими показателями анизотропии g и наибольшими коэффициентами рассеяния μs, отличаются наибольшими интенсивностями изображения. В то же время ткани с высоким показателем коэффициента анизотропии, в которых сравнительно небольшая часть фотонов отражается (рассеивается) назад, имеют относительно небольшую интенсивность на структурном изображении [10–12]. Данный факт подтверждает адекватность полученных результатов.
Результаты исследования и их обсуждение
Представлены гистограммы распределения усредненных областей кожи и сосуда, а также подгонка с помощью методов наименьших квадратов функция гамма-распределения является количественным выраженным эффектом гетерогенности тканей. Полученное значение коэффициента детерминации, R2, для гистограмм интенсивности демонстрирует существенные различия в значениях параметров формы и масштаба, соответствующие полученным отношениям α/β для области кожи и области крови, что позволяет уверенно проводить дифференциацию тканей и структур ОКТ изображений. Переход из области кожи в область кровеносного сосуда (рис. 3) явно выражен и определяется увеличением среднего значения отношения α/β для соответствующего гамма-распределения. Важно отметить, что площади гистограмм равны площадям соответствующим структурам на изображении.
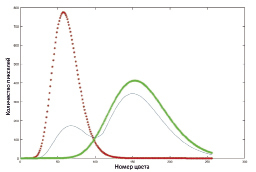
Рис. 3. Гистограмма перехода от ткани к области крови представлена линией синего цвета. Гистограмме крови соответствует красная линия, гистограмме кожи – зеленая
Данный метод позволяет обнаруживать изменения в типе тканей, и используется для анализа интенсивности пикселей и для обнаружения изменений в неоднородности тканей и выявления раковых клеток [5]. Этот метод был применен к 2D-изображениям, хотя его можно использовать и для анализа данных 3D объектов, анализируя трехмерные данные (С-сканы), что позволит учесть очертания сосудов и объемное картирование изменений свойств ткани.
Недостатком описанной реализации программы является использование большой области для реализации алгоритма скользящего ящика – 150×50 пикселей, а также применение усреднений, что приводит к некоторому пространственному размытию и усреднению по потенциально гетерогенным областям тканей. Дальнейшие систематические изменения размера и формы исследуемой области наверняка улучшат пространственное разрешение метода и минимизируют число усреднений, одновременно приводя к более точным подгонкам. При многопараметрическом подходе корреляция биологических событий с пространством биофизических метрических параметров может стать более реалистичной [7]. Можно предположить, что увеличение разрешения оптической система визуализации увеличит точность и производительность алгоритма.
Таким образом, представленный алгоритм количественного анализа пикселей ОКТ изображения на основе подгонки гамма распределения, демонстрирует эффективность в дифференциации различных типов изображений in vivo – структурных и функциональных. Представленный метод обладает потенциалом для обнаружения изменений структуры ткани, вызванных заболеваниями (рак кожи) или обусловленных функциональными изменениями (пульсации течения крови) [5–7]. Также возможно обнаружение границ гетерогенных структур с последующей визуализацией 3D объекта.
Выводы
В настоящей работе представленные результаты исследования, в котором, при помощи компьютерного алгоритма, были обработаны структурные ОКТ изображения слоёв кожи и кровеносного сосуда человека in vivo. Было выбрано несколько областей, которые содержали участки кожи и крови, после чего построены соответствующие гистограммы интенсивности пикселей. Для минимизации погрешности полученных гистограмм в алгоритм обработки было введено усреднение по различным областям изображения. Полученные графики были аппроксимированы функцией гамма-распределения с использованием метода наименьших квадратов. Параметры формы составили α/β = 2,7·10-4 для области крови и α/β = 7,0·10-4 для области кожи.
С помощью алгоритма «скользящего ящика» исследована область перехода от неподвижной ткани к крови. Результат построения гистограммы интенсивности определялся количественно по уменьшению амплитуды соответствующей амплитуды пика и формы распределения. Было выявлено, что каждой структуре биообъекта в ОКТ и УЗИ изображении соответствует пик распределения на гистограмме интенсивности пикселей, имеющий форму близкую к правильной форме гамма-распределения.
Дальнейшая работа будет связана с обработкой и сравнением 2D и 3D изображений, а также созданием автоматизированного программного комплекса, основанного на результатах приведённых вычислений. Дальнейшее развитие этого алгоритма позволит создать анатомические карты подкожных кровеносных сосудов человека и животных in vivo.
Библиографическая ссылка
Черешнев В.О., Романенко И.М., Кулешов И.В., Проскурин С.Г. ДИФФЕРЕНЦИАЦИЯ СТРУКТУР КОЖИ, КРОВЕНОСНЫХ СОСУДОВ И КРОВИ ПОСРЕДСТВОМ ПОСТРОЕНИЯ ВАРИАЦИОННОЙ МАТРИЦЫ ОКТ ИЗОБРАЖЕНИЯ // Современные наукоемкие технологии. 2019. № 10-2. С. 319-323;URL: https://top-technologies.ru/ru/article/view?id=37744 (дата обращения: 19.12.2025).



