Наиболее распространённым примесным металлом, от которого необходимо очищать растворы гидрохлоридного выщелачивания полиметаллического сырья, является, как правило, железо. Очистка солянокислых растворов гидролитическими методами невозможна без их глубокой нейтрализации, и поэтому жидкостная экстракция железа (III) из растворов хлороводородной кислоты относится к перспективным направлениям гидрометаллургии. Экстракционный способ является также наиболее эффективным при переработке высокожелезистых растворов, так как позволяет существенно уменьшить перевод железа в отвальные продукты [1].
Одними из наиболее перспективных реагентов для экстракционного извлечения элементов и кислот являются высокомолекулярные алифатические спирты, которые зарекомендовали себя в качестве самостоятельных экстрагентов железа (III) [2], рения (VII) [3], золота (III) [4], а также для регенерации серной кислоты [5]. Алифатические спирты производятся в больших масштабах и являются доступными и достаточно дешевыми реагентами.
Известно, что спирты имеют склонность к самоассоциации, которая возрастает у первичных спиртов с увеличением углеводородного радикала [6]. В связи с уменьшением концентрации активных мономеров спирта в результате его самоассоциации снижается и их эффективность в качестве экстрагентов. Одним из способов разрушения спиртовых ассоциатов с образованием мономеров является разбавление. Но для полного перевода спиртов в состояние мономера необходимо разбавление более чем в 100 раз [7], что невозможно при использовании спиртов в качестве экстрагентов. Однако в ряде публикаций по экстракции спиртами показано, что их разбавление инертными разбавителями может способствовать экстракции металлов. Так, в работе [8] показано, что ванадий (V) наиболее полно переходит в органическую фазу при его экстракции спиртами (октанол-1 и бутанол-1), разбавленными гептаном. Установлено, что экстракция железа (III) улучшается при разбавлении алифатических спиртов хлороформом [9, 10]. При составе органической фазы отанол-1: хлороформ в соотношении 3:1 наблюдается более полное удаление железа (III), таллия (III) и галлия (III) из водной фазы, нежели при использовании чистого спирта.
Целью настоящей работы является изучение экстракции железа (III) из растворов хлороводородной кислоты смесями изомеров октилового спирта с промышленными разбавителями.
Материалы и методы исследования
В качестве экстрагентов использовали алифатические спирты октанол-1 («Ч», производства ЗАО «Вектон», Россия), октанол-2 (марки «97 %», производства «Acros Organics», США), октанол-3 (марки «for synthesis», производства «Merck Schuchardt OHG», Германия) и 2-этилгексанол-1 (марки «≥ 99,6 %», производства «SIGMA-ALDRICH», США). В качестве инертных разбавителей – додекан («Ч», производства ЗАО «Вектон», Россия), а также импортные промышленные разбавители Solvesso 150 ND, представляющий собой 99 % смесь ароматических соединений, и Shellsol 2046 NA – смесь углеводородов (33 %), нафтенов (46 %) и ароматических соединений (19 %). В таблице указаны некоторые физические свойства органических веществ.
Некоторые физические свойства органических реагентов [11–14]
|
Реагент |
Молярная масса, г×моль-1 |
Температура вспышки, °С |
Растворимость, г×дм-3, 20 °С |
Плотность, г×см-3, 20 °С |
|
Октанол-1 |
130,136 |
81 |
0,540 |
0,829 |
|
Октанол-2 |
130,136 |
76 |
1,120 |
0,819 |
|
Октанол-3 |
130,136 |
67 |
1,250 |
0,825 |
|
2-этилгексанол-1 |
130,136 |
73 |
0,880 |
0,834 |
|
Додекан |
170,203 |
71 |
0,005 |
0,749 |
|
Shellsol 2046 NA |
189,000* |
84 |
Незначительная |
0,837 |
|
Solvesso 150 ND |
134,000* |
64 |
Незначительная |
0,890 |
Примечание. * – расчётная молярная масса разбавителей, приведённая в [13] и [14] соответственно.
Исследуемые растворы хлорида железа (III) определенной концентрации готовили растворением навески твердых солей в дистиллированной воде с добавлением расчетных количеств концентрированной соляной кислоты. Все использованные неорганические реагенты соответствовали квалификации «хч».
Жидкостную экстракцию проводили интенсивным перемешиванием смеси водной и органической, содержащей определённую концентрацию спирта, фаз при соотношении О:В = 1:1 в течение 5 минут при комнатной температуре. По окончании расслоения отделяли водную фазу от органической, используя делительные воронки. Реэкстракцию проводили дистиллированной водой при соотношении О:В = 1:1 и О:В = 1:5, по окончании расслоения водную фазу отделяли от органической. В полученных рафинате и реэкстракте определяли концентрацию железа (III) методом комплексометрического титрования. В качестве титрующего агента использовали динатриевую соль этилендиаминтетрауксусной кислоты, а для установления необходимого значения pH – ацетатный буферный раствор. Титрование проводили до перехода бордовой окраски в жёлтую. Концентрацию HCl в растворе определяли методом прямого титрования с использованием в качестве индикатора смеси метиленового голубого и метилового красного. Процесс проводили до перехода окраски из красной в зелёную. Концентрацию металлов и кислоты в органической фазе вычисляли по разности между их содержанием в водной фазе до и после экстракции.
Результаты исследования и их обсуждение
В ходе работы исследовано экстракционное извлечение железа (III) из раствора хлороводородной кислоты алифатическими спиртами различной концентрации (рис. 1). Полученные данные демонстрируют, что при экстракции спиртами с неразветвлённой структурой максимальный показатель степени извлечения достигается при концентрации спирта 80 об. %, но разбавление отрицательно влияет на экстракционную способность 2-этилгексанола-1.
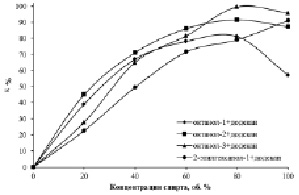
Рис. 1. Зависимость концентрации Fe (III) в органической фазе от концентрации экстрагента. C (HCl) = 6 моль·дм-3, C(Fe3+)водн. = 10 г·дм-3
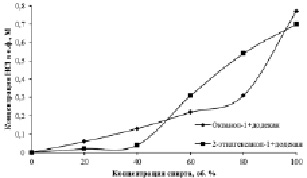
Рис. 2. Зависимость C(HCl), перешедшей в о.ф., от концентрации экстрагента. C(HCl)водн. = 6 моль·дм-3
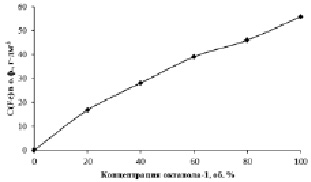
Рис. 3. Зависимость C(Fe3+), перешедшего в о.ф., от концентрации октанола-1. C(Fe3+)водн. = 223 г·дм-3
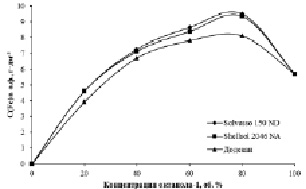
Рис. 4. Зависимость концентрации Fe (III), перешедшего в о.ф., от концентрации октанола-1 в различных разбавителях. C(HCl) = 6 моль·дм-3, C(Fe3+)водн. = 10 г·дм-3
Для изучения природы указанного явления изучено экстракционное извлечение хлороводородной кислоты при изменяющейся концентрации спирта (рис. 2). На полученной зависимости наблюдается резкое увеличение экстракции HCl октанолом-1, но зависимость экстракции 2-этилгексанолом-1 более пологая.
Таким образом, полученные данные могут объяснить природу появления пика для алифатических спиртов с неразветвленной структурой: при концентрации экстрагента 100 % наблюдается наиболее интенсивная экстракция хлороводородной кислоты, что влечёт за собой подавление экстракции железа (III). Для подтверждения выдвинутого объяснения была изучена зависимость степени извлечения железа (III) из его концентрированного водного раствора от концентрации октанола-1 (рис. 3).
Из данных, представленных на рис. 3, следует, что в отсутствии хлороводородной кислоты с ростом концентрации октилового спирта происходит линейное увеличение концентрации Fe (III) в органической фазе. Данный факт подтверждает вышеуказанное предположение о влиянии соэкстракции HCl на экстракционное извлечение железа.
При изучении влияния природы разбавителя на извлечение железа (III) октиловым спиртом обнаружено, что при использовании промышленных инертных разбавителей, содержащих ароматические соединения, наблюдается наиболее полный переход Fe (III) в органическую фазу (рис. 4). Полученные зависимости практически идентичны по форме, но железо (III) наиболее полно переходит в фазу экстрагента в ряду додекан < Shellsol 2046 NA < Solvesso 150 ND.
Наблюдаемую закономерность можно объяснить зависимостью степени ассоциации спирта от природы разбавителя. Как показано выше, Shellsol 2046 NA представляет собой смесь парафинов, нафтенов и ароматических соединений, а Solvesso 150 ND – разбавитель, основными компонентами которого являются ароматические соединения. Известно, что степень самоассоциации спиртов в бензоле в 3-4 раза меньше, чем, например, в циклогексане [15]. Следовательно, в ароматических разбавителях присутствует большее количество мономеров спирта и поэтому эти смеси проявляют более высокую экстракционную способность по отношению к железу (III).
Для подтверждения выдвинутого предположения установлена зависимость соэкстракции хлороводородной кислоты разбавленным октиловым спиртом при различном содержании ароматических соединений в разбавителе (рис. 5). Так, HCl соэкстрагируется в наименьшей степени при разбавлении спирта алифатическим разбавителем, но при этом наибольший показатель соэкстракции наблюдается при использовании в качестве разбавителя смесь алифатических, нафтеновых и ароматических углеводородов. Вероятно, при использовании ароматического разбавителя более полному переходу кислоты в органическую фазу мешает соэкстракция железа (III). Аналогичным образом можно объяснить отсутствие максимального значения экстракции кислоты при концентрации спирта 80 об. %.
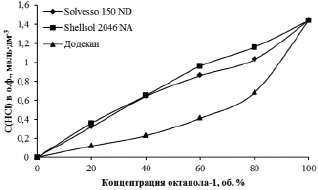
Рис. 5. Зависимость концентрации хлороводородной кислоты, перешедшей в о.ф. при экстракции железа (III), от концентрации октанола-1. C(HCl) = 6 моль·дм-3, C(Fe3+)водн. = 10 г·дм-3
Заключение
Исследовано экстракционное извлечение железа (III) изомерами октанола из растворов хлороводородной кислоты. Установлено, что среди неразветвлённых алифатических спиртов Fe (III) лучше экстрагируется вторичными спиртами, причем наиболее полно октанолом-3.
На примере соэкстракции хлороводородной кислоты 2-этилгексанолом-1 и октанолом-1, разбавленных додеканом, показано, что с уменьшением экстракции хлороводородной кислоты увеличивается переход железа (III) в фазу экстрагента.
Показано, что смеси октиловых спиртов с разбавителями являются перспективными экстрагентами для извлечения железа из солянокислых растворов.
При использовании ароматического разбавителя Solvesso 150 ND наблюдается наиболее высокое извлечение железа (III) в органическую фазу, а при использовании додекана – минимальное, что обусловлено бóльшим разрушением спиртовых ассоциатов ароматическими разбавителями по сравнению с алифатическими.
Библиографическая ссылка
Касиков А.Г., Соколов А.Ю. ЭКСТРАКЦИОННОЕ ИЗВЛЕЧЕНИЕ ЖЕЛЕЗА (III) ИЗ РАСТВОРОВ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ ИЗОМЕРАМИ ОКТАНОЛА В ИНЕРТНЫХ РАЗБАВИТЕЛЯХ // Современные наукоемкие технологии. 2019. № 3-2. С. 187-192;URL: https://top-technologies.ru/ru/article/view?id=37463 (дата обращения: 22.02.2026).
DOI: https://doi.org/10.17513/snt.37463



