Железо – жизненно важный для организма человека микроэлемент, который участвует в процессах кроветворения, дыхания, окислительно-восстановительных реакциях и иммунобиологических процессах. В организме взрослого человека железа содержится примерно 4 грамма, более половины (около 2,5 г) приходится на гемоглобин. Суточная потребность организма в этом микроэлементе составляет от 10 до 30 мг. Однако избыточное содержание железа может создавать питательную среду для роста вредных микроорганизмов и клеток злокачественных опухолей, осложняет протекание болезней Паркинсона и Альцгеймера. Этот элемент способен накапливаться до токсических концентраций в органах и тканях, включая печень, суставы, эндокринные железы и сердце [1].
Излишнее количество железа, поступающее извне в организм человека – это повышенный уровень этого микроэлемента в питьевой воде. По санитарным нормам России концентрация железа в воде для хозяйственно-бытовых нужд не должна превышать 0,3 мг/л [2]. Наличие избыточного количества железа можно определить и на вкус. При концентрации железа 1–1,5 мг/л вода имеет неприятный металлический привкус, желтовато-бурую окраску и повышенную мутность. Такая вода приводит в нерабочее состояние бытовую технику, систему отопления и нагревания воды, вызывает развитие железобактерий, отложение осадка в трубах и их засорение. Таким образом, удаление избыточного железа из воды (обезжелезивание), понижение его концентрации до норм ПДК является одной из насущных задач водоподготовки.
Одним из перспективных и эффективных методов является сорбционный. Для очистки воды от железа используются как природные сорбенты, так и синтетические. В настоящее время широко изучаются сорбционные свойства различных природных сорбентов [3–5]. Такие сорбенты, как правило, имеют невысокую стоимость, являются легкодоступными и возможно исключение стадии регенерации.
В Тюменской области имеются большие залежи природных сорбентов разного химического и минералогического состава. Поэтому исследование сорбционных свойств местных сорбентов является актуальным.
На кафедре общей и специальной химии Тюменского индустриального университета ведется исследовательская работа по изучению сорбционных свойств природных сорбентов к тяжелым металлам [6–8].
Цель исследования: в настоящей работе исследовались сорбционные свойства природных сорбентов – монтмориллонита и каолинита по отношению к ионам железа (III).
Материалы и методы исследования
Исследуемые сорбенты измельчали и использовали фракцию с размером зерен 1–2 мм. Исходный раствор с приближенной концентрацией 1 моль/л готовили растворением навески FeCl3?6H2O (квалификация «х.ч.») в бидистиллированной воде, а затем уточняли ее комплексонометрическим титрованием стандартным раствором ЭДТА в присутствии салициловой кислоты в качестве индикатора в среде ацетатного буфера [9]. Растворы меньшей концентрации получали разбавлением исходного раствора. Эксперимент проводили при температурах 298; 318 и 333 К. Исследуемый сорбент массой 1 г заливали 50 мл модельного раствора и оставляли до установления равновесия на 5 дней. Затем сорбент от раствора отделяли через плотный фильтр «синяя лента», анализировали остаточное содержание ионов железа и измеряли рН на иономере И-130. На основе результатов, полученных после титрования, рассчитывали величину сорбции и строили изотерму сорбции Ленгмюра в координатах «сорбция, ммоль/г – равновесная концентрация исследуемого катиона, ммоль/мл». Опыты проводили при трехкратном повторении. Относительные отклонения составили 0,7–8,5 %.
Природный каолинит – основной компонент многих глин. Он формируется при выветривании мелких частиц полевых шпатов, кварца и других горных пород под воздействием кислотной среды. Структура каолинита – чешуйчатая, состоит из многочисленных слоев. Каждый структурный слой каолинита состоит из тетраэдров Si – O4, имеющих три общих кислорода и связанных попарно через свободные вершины алюминием и гидроксидом. Из-за такой структуры химический состав каолинитов исключительно стабилен и изоморфные замещения практически отсутствуют. Монтмориллонит – глинистый минерал, относящийся к подклассу слоистых силикатов, группе смектитов. Структура монтмориллонита имеет вид симметрично сложенных пачек слоев. Благодаря присутствию изоморфных замещений, большой удельной поверхности (до 600–800 м2/г) и сравнительно легкому проникновению ионов в межпакетное пространство минерал имеет большую емкость катионного обмена [10].
В табл. 1 представлен химический состав исследуемых сорбентов, полученный с помощью электронной микроскопии [11, 12].
Таблица 1
Химический состав монтмориллонита и каолинита
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
|
Монтмориллонит |
||||||
|
М, % мас. |
54,0 |
20,73 |
0,75 |
3,07 |
0,44 |
9,43 |
|
Каолинит |
||||||
|
М, % мас. |
54,55 |
27,23 |
1,29 |
0,96 |
3,81 |
9,94 |
Результаты исследования и их обсуждение
По изотерме сорбции можно получить сведения о сорбционных свойствах исследуемых сорбентов. Для построения изотермы рассчитывали количественную характеристику сорбционного процесса – удельную адсорбцию (Г). Величину удельной адсорбции вычисляли по уравнению
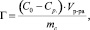
где С0 и Ср – исходная и равновесная концентрация ионов железа, ммоль/мл; V – объем модельного раствора, мл; mс – масса исследуемого сорбента, г.
Затем строили изотерму сорбции – графическую зависимость удельной адсорбции от равновесной концентрации ионов железа в модельных растворах. На рис. 1 представлены изотермы на монтмориллоните, на рис. 2 – на каолините.
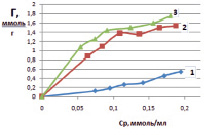
Рис. 1. Изотермы сорбции ионов железа из растворов хлорида железа (III) при различной температуре, К: 298 (1), 313 (2), 333 (3) на монтмориллоните
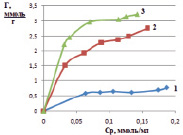
Рис. 2. Изотермы сорбции ионов железа из растворов хлорида железа (III) при различной температуре, К: 298 (1), 313 (2), 333 (3) на каолините
С увеличением концентрации ионов железа в исследуемых растворах и температуры удельная сорбция возрастает. Сорбционная емкость для каолинита составила 0,872 ммоль/г, для монтмориллонита – 0,598 ммоль/г. На приведенных изотермах в области равновесной концентрации 0,12 ммоль/мл (рис. 1), и в области концентрации 0,068 ммоль/мл (рис. 2) наблюдается перегиб, что говорит об изменении механизма сорбции. Можно предположить, что вначале сорбция ионов железа (III) происходит по ионообменному механизму. Такой процесс можно представить в виде схемы:
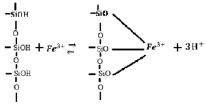
В дальнейшем сорбция ионов железа также протекает по ионообменному механизму, но на менее доступных активных центрах, расположенных на участках исследуемых сорбентов с более высокой степенью дисперсности.
В процессе сорбции концентрация ионов Fe3+ в растворе уменьшается, часть ионов подвергается гидролизу по первой ступени, что можно представить уравнением
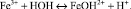
В результате гидролиза происходит непрерывное уменьшение величины водородного показателя (рН) среды. Величину рН можно расчитать по формуле
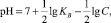 (1)
(1)
где KВ – константа диссоциации слабого основания, для Fe(OH)3, она равна 1,35?10-12 [13]; С – концентрация гидролизующихся катионов железа, моль/л.
Зависимость расчетной величины рН от концентрации ионов железа представлена на рис. 3, а, из которого видно, что при уменьшении концентрации ионов железа рН в растворе увеличивается. Такая же зависимость наблюдалась и в эксперименте – рН измеряли в исходных растворах, и в растворах после установления равновесия. На рис. 3, б, представлена зависимость рН от концентрации ионов железа (III) на монтмориллоните. Для каолинита получены подобные зависимости.
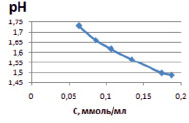
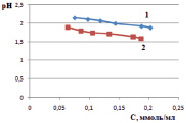
а) б)
Рис. 3. Зависимость рН раствора хлорида железа от концентрации ионов железа (III): а) расчетные значения; б) экспериментальные значения в исходных растворах до сорбции (1) и в растворах после сорбции (2)
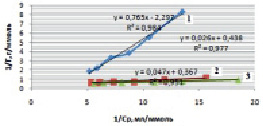
Рис. 4. Линейные изотермы Ленгмюра для сорбции ионов железа на монтмориллоните при различных температурах: 1 – 298 К, 2 – 318 К, 3 – 333 К
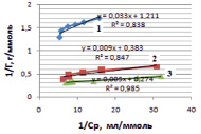
Рис. 5. Линейные изотермы Ленгмюра для сорбции ионов железа на каолините при различных температурах: 1 – 298 К, 2 – 318 К, 3 – 333 К
Изотермы адсорбции обрабатывали с помощью уравнения Ленгмюра:
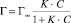 (2)
(2)
или в линейной форме [14]:
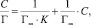 (3)
(3)
где Г – сорбционная емкость сорбента, моль/г; Г∞ – предельная сорбционная емкость монослоя, моль/г; K – константа сорбционного равновесия; С – равновесная концентрация ионов железа, моль/л.
Полученные линейные изотермы для монтмориллонита (рис. 4) и для каолинита (рис. 5) позволяют графически определить постоянные параметры адсорбционной изотермы Ленгмюра (Г∞ и K). На оси ординат отсекается отрезок, равный 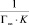 , а тангенс угла наклона полученной прямой tg∞ = 1/Г∞ [15].
, а тангенс угла наклона полученной прямой tg∞ = 1/Г∞ [15].
Рассчитанные значения постоянных величин уравнения Ленгмюра приведены в табл. 2.
Таблица 2
Параметры сорбции ионов железа (III) на природных сорбентах при различных температурах
|
Температура, К |
1 ступень |
2 ступень |
||||
|
Г∞, ммоль/г |
K, г/ммоль |
R2 |
Г∞, ммоль/г |
K, г/ммоль |
R2 |
|
|
монтмориллонит |
||||||
|
298 |
19,31 |
54,33 |
0,984 |
2,85 |
6,84 |
0,992 |
|
318 |
11,28 |
32,13 |
0,977 |
1,86 |
3,54 |
0,924 |
|
333 |
3,46 |
0,59 |
0,951 |
0,72 |
3,25 |
0,961 |
|
каолинит |
||||||
|
298 |
21,13 |
65,23 |
0,838 |
4,76 |
51,62 |
0,986 |
|
318 |
12,56 |
41,72 |
0,847 |
3,25 |
32,03 |
0,964 |
|
333 |
6,34 |
1,61 |
0,985 |
4,25 |
12,24 |
0,955 |
Сравнивая величины параметров сорбционного процесса, представленные в табл. 2, видно, что каолинит обладает большим числом активных центров, чем монтмориллонит. Сродство к ионам железа проявляется у каолинита также в большей степени.
Константа сорбционного взаимодействия (К) пропорциональна энергии взаимодействия молекул сорбтива с адсорбентом. Чем больше величина К, тем сильнее такое взаимодействие. Из представленных данных табл. 2 следует, что при увеличении температуры энергия взаимодействия молекул сорбтива с адсорбентом уменьшается.
Выводы
В результате проведенных исследований по извлечению ионов железа (III) из водных растворов в статических условиях выявлено, что природные сорбенты – каолинит и монтмориллонит – обладают сорбционными свойствами по отношению к ионам железа (III). Изотермы сорбции ионов железа (III) в широком интервале концентраций раствора FeCl3?6H2O подчиняются уравнению Ленгмюра. Рассчитаны предельные значения сорбции катионов железа (III) на монтмориллоните и каолините, что позволяет предположить использование исследованных сорбентов для извлечения Fe3+ из водных растворов.
Библиографическая ссылка
Полещук И.Н., Пинигина И.А., Созыкина Е.С. ИЗВЛЕЧЕНИЕ ИОНОВ ЖЕЛЕЗА (III) ИЗ ВОДНЫХ РАСТВОРОВ ПРИРОДНЫМИ СОРБЕНТАМИ // Современные наукоемкие технологии. 2019. № 3-1. С. 65-69;URL: https://top-technologies.ru/ru/article/view?id=37443 (дата обращения: 02.01.2026).



