Молекула ацетилена является универсальным «строительным блоком» в синтезе органических продуктов. Долгое время он занимал лидирующую позицию среди основного химического сырья и находился практически вне конкуренции, так как ацетилен и его производные, как высокореакционноспособные соединения, в большей степени, чем этилен, отвечают тенденциям развития химической промышленности, ориентированной на разработку наукоемких химических продуктов для современных технологий, сельского хозяйства и медицины [1]. Нестабильная ситуация на рынке нефти, наличие больших залежей каменного угля в Центральном Казахстане и карбидного производства на АО «Темиртауский электрометаллургический комбинат» (Карагандинская область, г. Темиртау) создает объективные предпосылки к активному использованию ацетилена для целей тонкого органического синтеза. При этом в недалеком будущем может сложиться конъюнктура, при которой ацетилен в качестве сырья для химической промышленности станет вновь более выгодным экономически, чем этилен.
Среди синтезируемых на основе ацетилена веществ наиболее значимы этанол и ацетиленовые спирты, уксусный альдегид и уксусная кислота, полиакрилонитрил и поливинилхлорид, различные каучуки (дивинильный, хлоропреновый и изопреновый), среди биологически активных веществ – витамин А и стероидные гормоны. Различные производные ацетилена имеют все большую перспективу применения для целей тонкого органического синтеза. Ацетиленовые спирты, в особенности гликоли, вызывают особый интерес. Уже сейчас имеются предпосылки для разработки на их основе производств душистых, лекарственных и фотоактивных веществ, мономеров в синтезе полимеров и флотореагентов, специальных полимерных материалов, а также пластификаторов и модификаторов для них, антикоррозийных средств защиты оборудования, модификаторов моторных топлив и эмульгаторов [1, 2].
Разработка методов синтеза ацетиленовых диолов является актуальным направлением исследований и в настоящее время. Так, в работе [3] сообщается о пятишаговом синтезе диацетиленовых диолов на основе коммерчески доступного 1,4-бис(триметилсилил)бута-1,3-диина и различных альдегидов. По результатам оценки биологической активности и безопасности ряда полученных ими производных установлено, что соединения 1а, 1b и 1c являются перспективными для in vivo изучения их как средств профилактики рака.
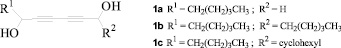
Авторами работы [4] описан синтез 1,4-диолов в мягких условиях на основе терминальных ацетиленов 2 путем активации С-Н связи с получением металлацетиленида. Первый этап синтеза протекает в присутствии Zn (II), триэтиламина и N-метилэфедрина (оптически активного аминоспирта). Полученный in situ металлацетиленид в реакции присоединения по С=О и С=N связям образует соответствующие 1,4-диолы 3 (схема 1).
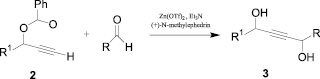
Схема 1. Синтез 1,4-диолов на основе терминальных ацетиленов
В работе [5] приведен эффективный хемоселективный способ получения алкиндиолов путем прямого депротонирования пропаргиловых спиртов 4 n-бутиллитием (схема 2). Образующиеся соли 5 в присутствии эквимолярных количеств CeCl3 взаимодействуют с карбонильными соединениями и дают пропаргиловые диолы 6 с высокими выходами (даже в случае использования карбонильных соединений с низкой реакционной способностью).
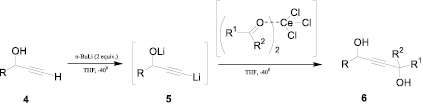
Схема 2. Синтез алкиндиолов прямым депротонированием пропаргиловых спиртов
Получение ацетиленовых спиртов по технологиям Фаворского и Реппе (прямой конденсацией алициклических кетонов и некоторых альдегидов с монозамещенными ацетиленами) в присутствии оснований остается одним из наиболее простых методов [1, 6]. 2-метил-4-фенилбутан-3-ол-2 – первый продукт данной технологии, полученный одностадийно и с количественным выходом путем конденсации ацетона с фенилацетиленом в присутствии порошковатого едкого калия. В дальнейшем данную технологию распространили на другие монозамещенные ацетилены и сам ацетилен. Процесс проводят при значительном избытке ацетилена (вместо которого может быть применен и карбид кальция в присутствии KOH) в среде различных органических растворителей или их смесей (диизопропиловом или метилтретбутиловом эфире, смеси ацетальдегида с дибутилацеталем или метилаля с диоксаном; тетрагидрофуране и т.п.) [6].
В свете вышеизложенного, целью данного исследования стал синтез по классической реакции Фаворского перспективного функционального производного ацетилена – диметилдигексилбутиндиола. Данное соединение представляет практический интерес, так как является симметричным производным, содержит в своей структуре одновременно две гидроксильные группы, тройную связь и углеводородный радикал с длинной углеродной цепью, что дает возможность использовать его для получения полимеров, эмульгаторов и флотореагентов с заданными характеристиками. Среди перечисленного наиболее актуальным, на наш взгляд, представляется применение производных данного соединения в процессе флотации при обогащении медных и серебряных руд, поскольку в Казахстане нет собственного производства флотореагентов, и данный вид продукции закупается потребителями за рубежом.
Материалы и методы исследования
Для проведения синтеза использовали ацетилен, получаемый из карбида кальция, октанон-2 (метилгексилкетон), порошок КОН и бензол (в качестве растворителя). Для осушки использовали прокаленный поташ, для перекристаллизации применяли четыреххлористый углерод.
Синтез проводили в трехгорлой колбе объемом 500 мл с обратным холодильником, капельной воронкой и мешалкой, аналогичной представленной в работе [7]. Ацетилен осушали и очищали от примесей, пропуская через склянку Тищенко, заполненную концентрированной H2SО4. Конец обратного холодильника установки также был соединен с ней для защиты системы от попадания влаги и обеспечения возможности визуального наблюдения за поглощением ацетилена.
Для определения структуры нового ацетиленового спирта использовалась ЯМР-спектроскопия высокого разрешения, которая является одним из самых информативных методов исследования структуры и превращений молекул, межмолекулярных взаимодействий и количественного анализа веществ. Анализ выполнялся в лаборатории инженерного профиля ЯМР-спектроскопии Кокшетауского государственного университета им. Ш. Уалиханова на приборе JNM-ECA 400 (Jeol, Япония, рабочая частота 400 МГц). Модельные спектры 1Н и 13С ЯМР соединений построены с помощью программы ACDLab ChemSketchWindow. Температуру плавления определяли с помощь прибора OptiMelt.
В колбу помещали 80 г порошка едкого калия, наливали 300 мл бензола (растворителя) и добавляли 25 г метилгексилкетона. Через реакционную смесь пропускают очищенный ацетилен в течение 2 ч при постоянном перемешивании. Температуру среды поддерживают на уровне 13–15 °С, охлаждая водопроводной водой. После окончания реакции смесь оставляют на ночь. Гидролиз осуществляют, прибавляя дистиллированную воду из капельной воронки (70–80 мл). Затем бензольный слой отделяют, а водный экстрагируют тремя порциями бензола по 30 мл. Органический слой и вытяжки от экстракции водного слоя объединяют, промывают водой (20 мл), 20 %-ной уксусной кислотой (20 мл), снова водой (20 мл), после чего сушат прокаленным поташом. Бензол отгоняют на ротационном испарителе. Продукт реакции – диметилдигексилбутиндиол, остается в колбе в виде кристаллов. Перекристаллизацию осуществляют из четыреххлористого углерода. Практический выход составляет 60–70 %.
Диметилдигексилбутиндиол, синтезированный по данному способу, представляет собой аморфный порошок светло-желтого цвета с температурой плавления 85 °С, хорошо растворимый в хлороформе.
Результаты исследования и их обсуждение
Предполагаемый механизм реакции получения диметилдигексилбутиндиола по классической реакции Фаворского при взаимодействии ацетилена с метилгексилкетоном в присутствии порошковатого КОН (схема 3) включает образование ацетиленида, который присоединяется к карбонильному соединению с образованием in situ промежуточного продукта – алкоголята ацетиленового спирта, при гидролизе которого с выходом 60–70 % образуется целевой продукт – ацетиленовый спирт диметилдигексилбутиндиол.
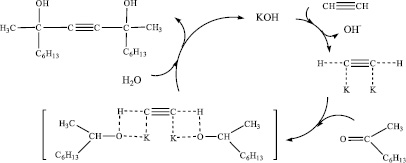
Схема 3. Предполагаемый механизм реакции взаимодействии ацетилена с метилгексилкетоном
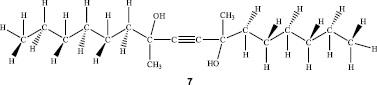
Для идентификации и подтверждения предполагаемой структуры синтезированного соединения 7 были сняты 1Н и 13С ЯМР-спектры в дейтерированном хлороформе и спектр HMQC. Полученные результаты представлены на рис. 1–3 и в таблице.
В протонном спектре синтезированного соединения наиболее сильнопольный сигнал (триплет, 0,85 м.д.) интенсивностью 6Н принадлежит протонам метильных групп двух гексильных заместителей. Мультиплетные сигналы с химическими сдвигами 1,27; 1,42 и 1,59 м.д. можно отнести к протонам метиленовых групп алкильного радикала. Для протонов метильных заместителей характерно резонирование при 1,42 м.д.
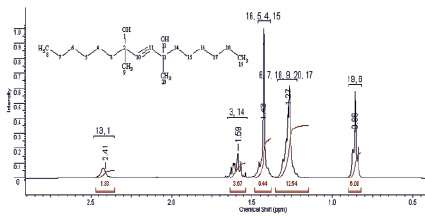
Рис. 1. Спектр 1Н ЯМР диметилдигексилбутиндиола (400 МГц, СDCl3)
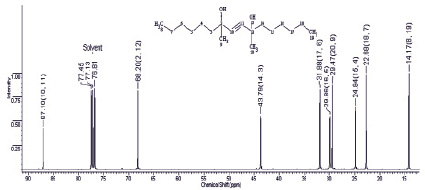
Рис. 2. Спектр 13С ЯМР диметилдигексилбутиндиола (400 МГц, СDCl3)
В 13С спектре соединения 7 углеродные атомы гексильных радикалов, расположенные симметрично, резонируют при 14,13 (2СН3), 22,67 (2СН2), 24,81 (2СН2), 29,65 (2СН2), 31,87 (2СН2) и 43,77 м.д. (2СН2). Атомы С-9 и С-20 метильных радикалов дают сигналы при 29,46 м.д. Под влиянием гидроксильных групп и кратной связи четвертичные атомы С-10 и С-11 в соединении дают сигнал в более слабом поле (68,20 и 87,15 м.д. соответственно).
Таким образом, на основании данных 1Н и 13С ЯМР-спектроскопии синтезированного соединения доказано, что структура этого экспериментального образца полностью соответствует диметилдигексилбутиндиолу (7,10-диметил-гексадек-8-ин-7,10-диолу).
Данные спектров 1Н и 13С ЯМР диметилдигексилбутиндиола
|
Данные 1Н спектра ЯМР |
Данные 13С спектра ЯМР |
||||||||
|
№ |
Атом |
Химический cдвиг (ppm) |
№ |
Атом |
Химический cдвиг (ppm) |
||||
|
эксп. |
расч. |
разница |
эксп. |
расч. |
разница |
||||
|
1 |
3 |
[1,53…1,65] |
– |
– |
1 |
19 |
14,17 |
14,07 |
+0,10 |
|
2 |
14 |
[1,53…1,65] |
– |
– |
2 |
8 |
14,17 |
14,07 |
+0,10 |
|
3 |
1 |
[2,36…2,48] |
– |
– |
3 |
18 |
22,63 |
22,46 |
+0,23 |
|
4 |
13 |
[2,36…2,48] |
– |
– |
4 |
7 |
22,63 |
22,46 |
+0,23 |
|
5 |
8 |
[0,82…0,90] |
0,877 |
–0,019 |
5 |
15 |
24,34 |
24,50 |
+0,34 |
|
6 |
19 |
[0,82…0,90] |
0,877 |
–0,019 |
6 |
4 |
24,34 |
24,50 |
+0,34 |
|
7 |
6 |
[1,22…1,34] |
1,276 |
+0,006 |
7 |
20 |
29,47 |
29,60 |
–0,13 |
|
8 |
17 |
[1,22…1,34] |
1,276 |
+0,006 |
8 |
9 |
29,47 |
29,60 |
–0,13 |
|
9 |
7 |
[1,22…1,34] |
1,333 |
–0,050 |
9 |
16 |
29,86 |
30,42 |
–0,56 |
|
10 |
18 |
[1,22…1,34] |
1,333 |
–0,050 |
10 |
5 |
29,86 |
30,42 |
–0,56 |
|
11 |
9 |
[1,22…1,34] |
1,356 |
–0,076 |
11 |
17 |
31,88 |
31,60 |
+0,28 |
|
12 |
20 |
[1,22…1,34] |
1,356 |
–0,076 |
12 |
6 |
31,88 |
31,60 |
+0,28 |
|
13 |
4 |
[1,39…1,46] |
1,389 |
+0,036 |
13 |
14 |
43,79 |
43,96 |
–0,17 |
|
14 |
15 |
[1,39…1,46] |
1,389 |
+0,036 |
14 |
3 |
43,79 |
43,96 |
–0,17 |
|
15 |
5 |
[1,39…1,46] |
1,518 |
–0,092 |
15 |
12 |
68,20 |
65,64 |
+2,56 |
|
16 |
15 |
[1,39…1,46] |
1,518 |
–0,092 |
16 |
2 |
68,20 |
65,64 |
+2,56 |
|
17 |
10 |
87,10 |
87,29 |
–0,19 |
|||||
|
18 |
11 |
87,10 |
87,29 |
–0,19 |
|||||
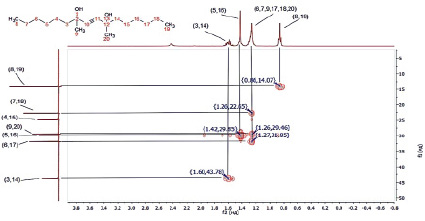
Рис. 3. Спектр HMQC диметилдигексилбутиндиола
Выводы
В результате проведенных исследований получено соединение, обладающее рядом уникальных свойств ввиду наличия в его структуре функциональных групп и тройной связи. Такая структура дает возможность получать на его основе производные с широким спектром применения. Ацетиленовые диолы в целом и диметилдигексилбутиндиол в частности предполагают высокую вероятность успешности их использования при флотации цветных руд, получении модификаторов и пластификаторов для пластмасс, а также наноструктурированных пленок, полимеров с заданными свойствами и противоопухолевых лекарственных средств.
Преимущества использованного метода синтеза диметилдигексилбутиндиола перед другими технологиями заключается в его безопасности, экономичности и более высокой интенсивности процесса. Так, синтез осуществляется при практически комнатной температуре, ацетилен используется при атмосферном давлении, целевой продукт легко отделить простой отгонкой растворителя, не образуются вредные выбросы и отходы.
Библиографическая ссылка
Меркулов В.В., Алмазов А.И., Мантлер С.Н., Жуманазарова Г.М. СИНТЕЗ НЕПРЕДЕЛЬНОГО АЦЕТИЛЕНОВОГО СПИРТА – ДИМЕТИЛДИГЕКСИЛБУТИНДИОЛА // Современные наукоемкие технологии. 2019. № 3-1. С. 54-59;URL: https://top-technologies.ru/ru/article/view?id=37441 (дата обращения: 04.03.2026).



