Поликристаллические керамические материалы на основе переходных элементов состава ZnMe2O4 (Me = Fe3+, Cr3+) широко используются в ряде важных технологических процессов. Например, ZnCr2O4 проявляет повышенную каталитическую активность в реакциях дегидроциклизации CH2(NH2)-CH2(NH2) в синтезе с глицерином [1], метилирования толуола (C6H5-CH3) с использованием синтез-газа [2], кетонизации карбоновых кислот [3]. ZnFe2O4 может быть использован как анод литий-ионных аккумуляторов [4], сенсор [5], адсорбент катионов тяжелых металлов [6]. Одним из перспективных направлений применения ферритов и хромитов цинка является использование их в качестве фотокатализатора [7, 8]. Научный интерес к синтезу и изучению свойств оксидных соединений в системе ZnMe2O4 (Me = Fe3+, Cr3+) стабильно высокий.
Синтез оксидных соединений со структурой шпинели может быть осуществлен как с применением классической керамической технологии [9, 10], так и с применением различных активированных методов, среди которых можно выделить гидротермальные, механохимические процессы и т.п. Формирование структуры шпинели в ходе классической керамической технологии позволяет получать материалы с заданным, точно контролируемым составом. Однако такие образцы имеют высокую степень окристаллизованности, что является неблагоприятным фактором в каталитических процессах. Кроме того, синтез твердых материалов из оксидов – длительный и энергоемкий процесс. Получение материалов с применением гидротермальных методов либо механическая активация поверхности исходных оксидов требуют применения специализированной аппаратуры, что не во всех случаях оказывается экономически целесообразным. Для синтеза наноразмерных ферритов и хромитов со структурой шпинели наиболее широко применяют метод М. Печини с использованием в качестве структурообразующего вещества органического темплата, например, глицин [11], лимонную кислоту [12], полиакридамид [13]. Как правило, в классическом варианте реализации подобной технологии, используют нитраты металлов, соответствующих рецептуре, этиленгликоль в качестве структурообразующего прекурсора. Получение наноструктурированных материалов позволяет управлять процессом синтеза образцов с развитой поверхностью. Данное обстоятельство приобретает исключительную важность в реакциях, для которых оценкой эффективности выступает число активных центров на единицу массы образца, в первую очередь – адсорбционными, каталитическими. В этой связи основной целью настоящего исследования было изучение возможности получения образцов со структурой шпинели в системе ZnMe2O4 (Me = Fe3+, Cr3+) с применением двух органических прекурсоров, характеристика особенностей структуры и каталитической активности материалов в реакции окислительной деструкции пероксидом водорода органического красителя.
Материалы и методы исследования
Для приготовления образцов ферритов и хромитов цинка были использованы растворы солей переходных металлов с концентрацией 1,0 моль/л, приготовленные из реактивов квалификации «хч»: нитрата железа (III) 9-водного Fe(NO3)3·9H2O, сульфата хрома (III) 18-водного Cr2(SO4)3·18H2O, нитрата цинка (II) 6-водного Zn(NO3)2·6H2O. Растворы отмеряли в стехиометрическом соотношении, затем помещали в реакционный сосуд из нержавеющей стали, добавляли при интенсивном перемешивании концентрированный водный раствор NH3, при этом значения рН поддерживали в интервале 7,5–8. Образующийся осадок гидроксидов переходных металлов растворяли в растворе лимонной кислоты с концентрацией 6,0–7,0 моль/л, выпаривали. Образовавшийся сухой остаток подвергали термообработке до полного разложения органической составляющей. С применением таких технологических приемов были получены образцы феррита цинка ZnFe2O4 (образец 1), хромита цинка ZnCr2O4 (образец 2), смешанного феррита-хромита цинка состава ZnFe0.6Cr1.4O4 (образец 3).
С целью изучения влияния органического прекурсора на процесс фазообразования в оксидной системе ZnO-Fe2O3, был получен образец феррита цинка по методике, описанной выше, с заменой лимонной кислоты на полиакриламид (образец 4).
Фазовый состав полученных материалов изучали на дифрактометре ARL X’TRA, использовали Cu-Kα излучение. Идентификацию фазы шпинели проводили по линиям 220, 311, 400, 422, 440. Для определения площади поверхности порошков использовали метод БЕТ, применяли аппарат ChemiSorb 2750 в Центре коллективного пользования «Нанотехнологии» Южно-Российского государственного политехнического университета (НПИ) имени М.И. Платова.
Определение среднего размера кристаллов формирующихся шпинелей D, нм, проводили по уравнению Дебая – Шеррера по линии 311:
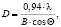
где λ = 1,5406 нм – длина волны, В – полная ширина пика на уровне половины интенсивности, θ – угол дифракции.
Каталитическую активность полученных образцов изучали на модельном растворе органического красителя метилового оранжевого по методике, подробное описание которой приведено в работе [14]. Определение концентации метилового оранжевого в растворе проводили фотоколориметрическим методом. Степень каталитической деструкции (Р) вычисляли по формуле
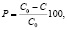
где С0 – начальная концентрация раствора, мг/л; С – текущее значение концентрации раствора, мг/л.
Результаты исследования и их обсуждение
В результате проведенного исследования был получен ряд образцов в виде пористых рыхлых материалов темно-зеленого (для хром-содержащих систем) и черного (феррит цинка) цвета. Рентгенограммы синтезированных образцов приведены на рис. 1 (на рисунке индексированы линии, принадлежащие шпинели). Согласно полученным данным, образцы 2 и 3 (рис. 2, 3, а) содержат (дополнительно к фазе шпинели) примесную фазу сульфата цинка ZnSO4·H2O. Для исключения примесной фазы образцы дополнительно термообработали в течение 30 мин при температуре 800 °С. По окончании данной операции все полученные материалы представляли собой однофазные образцы со структурой кубической шпинели (рис. 1): образец 1 – феррит цинка (Franklinite, PDF Number 010-70-6490), образец 2 – хромит цинка (Zincochromite, PDF Number 010-75-4052), образец 3 – смешанный феррит-хромит цинка (Franklinite, chromian, PDF Number 010-79-5287), образец 4 – феррит цинка (Franklinite, PDF Number 010-74-2397). Параметры элементарной ячейки, рассчитанные значения среднего размера кристаллитов приведены в табл. 1.
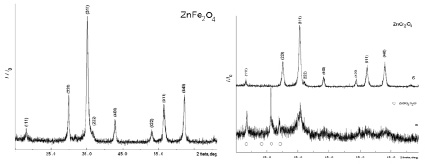
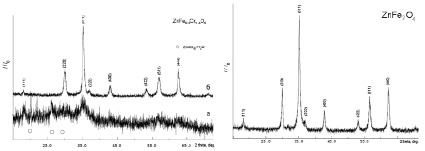
Рис. 1. Рентгенограммы образцов; феррита цинка (образец 1), хромита цинка (образец 2), феррита-хромита цинка (образец 3), феррита цинка (образец 4)
Таблица 1
Параметры решетки, средний размер кристаллов D и значения площади поверхности SBET шпинелей
|
№ п/п |
Состав |
Органический прекурсор |
Параметр решетки а, нм |
D, нм |
SBET, м2/г |
|
1 |
ZnFe2O4 |
Лимонная кислота |
0,8444 |
3,2 |
453,1 |
|
2 |
ZnFe0.6Cr1.4O4 |
Лимонная кислота |
0,8333 |
2,1 |
74,8 |
|
3 |
ZnCr2O4 |
Лимонная кислота |
0,8346 |
2,5 |
53,6 |
|
4 |
ZnFe2O4 |
Полиакриламид |
0,8443 |
1,9 |
207,3 |
Согласно полученным данным, по мере изоморфного замещения катионов железа катионами хрома в составе твердого раствора ZnFe2-xCrxO4, в системе происходит уменьшение значения параметра кристаллической решетки. Замена органического прекурсора практически не влияет на величину параметра кристаллической решетки.
Образующийся материал для всех образцов имеет вид рыхлого пористого порошка с развитой поверхностью. Для сравнительной характеристики на рис. 2 приведены микрофотографии образцов феррита цинка, синтезированного с применением различных органических прекурсоров (образцы 1 и 4).
Процесс фазообразования в сложной оксидной системе ZnFe2-xCrxO4 может протекать по следующему механизму. При растворении исходных солей происходит их диссоциация по уравнениям
Fe(NO3)3·9H2O = Fe3+ + 3NO3- + 9Н2О,
Zn(NO3)2·6H2O = Zn2+ + 2NO3- + 6Н2О,
Cr2(SO4)3·18H2O = 2Cr3+ + 3SO42- + 18Н2О.

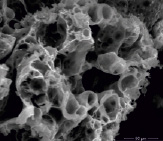
а) б)
Рис. 2. Микрофотографии образцов феррита цинка: а) образец 1, б) образец 4
Ведение в систему раствора аммиака, являющегося источником гидроксид-ионов, образуются осадки, имеющие различную окраску:
Fe3+ + 3OH- = Fe(OH)3 (буро-коричневый),
Zn2+ + 2OH- = Zn(OH)2 (белый),
Cr3+ + 3OH- = Cr(OH)3 (зеленый),
при введении лимонной кислоты полученные осадки растворяются с образованием вязкого раствора оливкового цвета, содержащего, по-видимому, цитраты переходных элементов
Cr(OH)3 + C6H8O7 = Cr(C6H5O7) + 3H2O,
Zn(OH)2 + C6H8O7 = Zn(C6H6O7) + 2H2O,
Fe(OH)3 + C6H8O7 = Fe(C6H5O7) + 3H2O,
которые находятся в растворе в виде хелатных комплексов с участием катионов хрома, железа и цинка (ZnCr2O4 (рис. 3, схема 1), ZnFe2O4 (рис. 3, схема 2), ZnFe0.6Cr1.4O4 рис. 3, схема 3)).
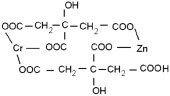
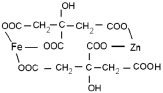
1) 2)
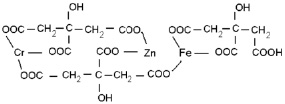
3)
Рис. 3. Схемы промежуточных соединений с участием лимонной кислоты: 1) ZnCr2O4, 2) ZnFe2O4, 3) ZnFe0.6Cr1.4O4
Нагревание реакционной системы приводит к разложению этих комплексов с формированием структуры шпинели состава ZnFe2-xCrxO4.
Если в системе присутствует сульфат хрома (III), возможно протекание дополнительной реакции формирования сульфата цинка
Zn2+ + SO42- = ZnSO4,
который при проведении дополнительной термообработки разлагается с формированием однофазной кубической шпинели.
Формирование структурообразующего комплекса шпинели в присутствии полиакриламида может быть представлено схемой (рис. 4).
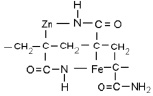
Рис. 4. Схема промежуточного соединения получения ZnFe2O4 с полиакриламидом
Каталитическую активность полученных шпинелей изучали на примере реакции окислительной деструкции пероксидом водорода Н2О2 органического красителя (метилового оранжевого). Согласно полученным данным установлено, что все изученные материалы являются каталитически активными в процессе Фентона. На рис. 5 приведена временная зависимость количества метилового оранжевого, который подвергся деструкции.
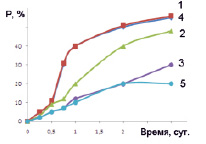
Рис. 5. Временная зависимость степени разложения метилового оранжевого, обозначения: 1 – образец 1, 2 – образец 2, 3 – образец 3, 4 – образец 4, 5 – система без катализатора
Согласно полученным данным, степень деструкции органического красителя в исследуемом каталитическом процессе увеличивается с увеличением степени дисперсности шпинелей. Наиболее высокую активность проявляют образцы феррита цинка, однако для образцов 1 и 4, полученных с введением разных органических прекурсоров (лимонной кислоты и полиакриламида), этот показатель практически одинаков. Такой результат может быть связан с наличием наиболее развитой поверхности у образцов феррита цинка. Полученные в ходе проведенного исследования результаты могут быть полезны при выборе перспективных материалов и технологий их синтеза. Оксидные системы на основе ферритов цинка могут быть использованы в системах водоподготовки промышленных предприятий, использующих в производственных циклах органические красители.
Выводы
В исследовании предложен механизм формирования пористой структуры шпинели в системе ZnFe2-xCrxO4. Показано, что в составах, содержащих хром, возможно образование сульфата цинка, для удаления которого требуется дополнительная термообработка материала. Это приводит к снижению площади поверхности синтезированных образцов и, как следствие, к каталитической активности. Наиболее высокую активность проявляют образцы феррита цинка. Синтезированные шпинели и разработанные технологические приемы их получения могут быть полезны для выбора перспективных материалов для применения в системах очистки сточных вод промышленных предприятий.
Библиографическая ссылка
Шабельская Н.П., Зеленская Е.А., Семченко В.В., Деева А.С., Нестеров А.А. ФОРМИРОВАНИЕ СТРУКТУРЫ И СВОЙСТВА ШПИНЕЛЕЙ В СИСТЕМЕ ФЕРРИТ-ХРОМИТ ЦИНКА // Современные наукоемкие технологии. 2018. № 12-1. С. 162-167;URL: https://top-technologies.ru/ru/article/view?id=37280 (дата обращения: 13.02.2026).



