Самый простой и эффективный способ использования угля в энергетической отрасли – его прямое сжигание [1]. Один из подходов, направленных на интенсификацию процесса горения угля, заключается в использовании промотирующих агентов, позволяющих улучшить кинетические характеристики горения и повысить эффективность сгорания угля [2]. Существующий опыт исследований инициируемого горения твёрдых топлив основан на использовании оксидов щелочноземельных и переходных металлов [3–4], а также различных солей и щелочей [5–6].
Рядом исследователей показано, что использование соединений щелочных и щелочноземельных металлов в качестве промотирующих добавок способствует ускорению процесса возгонки летучих веществ и снижению температуры воспламенения углей [7]. В присутствии добавок наблюдается интенсификация процессов термической деструкции угольной матрицы и дальнейшего окисления конденсированных продуктов [8]. Тем не менее использование добавок на основе щелочных и щелочноземельных металлов в энергетической отрасли ограничено высокой коррозионной активностью и высоким шлакообразованием [3].
Для повышения эффективности горения угля также используются оксиды редкоземельных и переходных металлов [9]. Так, в работе [3] рассмотрено влияние добавок CeO2, Fe2O3 и совместного использования Fe2O3 и К2CO3 на кинетические характеристики горения углей различной степени метаморфизма. Результаты термического анализа показали, что совместная добавка (Fe2O3 + К2CO3) оказывала положительное действие на процессы термической деструкции и горения различных видов твёрдого топлива. Отмечено, что наибольшие изменения в процессе горения угля с использованием оксидов металлов проявляются для высокоуглеродистых углей в высокотемпературной зоне (выше 550 °С).
При этом многие нитраты характеризуются сильными окислительными свойствами, низкой температурой плавления (разложения) и прекрасной растворимостью в воде. Последнее значительно упрощает их нанесение методом пропитки на поверхность твёрдого топлива. Например, использование NiNO3 в качестве инициирующей добавки приводило к максимальному снижению температуры зажигания углей (около 50 °С), по сравнению с добавками оксидов металлов. К тому же разложение нитратов переходных металлов приводит к образованию соответствующих оксидов, способных катализировать процесс дальнейшего окисления угля [5].
Цель исследования
Экспериментальное определение изменения реакционной способности бурых углей, модифицированных нитратами церия и меди (5 мас. %) методом ТГА и масс-спектрометрии.
Материалы и методы исследования
В качестве исходных образцов были взяты бурые угли Бородинского (Образец УБ-1) и Балахтинского (Образец УБ-2) разрезов Канско-Ачинского угольного бассейна.
Крупнодисперсные образцы (d = 5÷10 мм), исходно взятые для эксперимента, измельчались в барабанной мельнице в следующем режиме помола: соотношение массы мелющих тел к материалу 1:1, время помола 9 часов с дальнейшим фракционированием (d < 80 мкм). Полученные микродисперсные порошки углей были предварительно высушены при температуре 105 °С до постоянной массы.
Физико-химические характеристики подготовленных образцов были определены с помощью стандартных методик [10]. Результаты определения характеристик исходных образцов бурых углей представлены в таблице.
Характеристики исходных образцов углей и реагентов
|
Характеристика |
Образец бурого угля |
|
|
УБ-1 |
УБ-2 |
|
|
Зольность, мас. % |
4,5 |
3,6 |
|
Влажность, мас. % |
2,2 |
1,8 |
|
Летучие вещества, мас. % |
39,8 |
35,3 |
|
Углерод, мас. % |
53,5 |
59,3 |
|
*Влагоёмкость, мл/г |
3,2 |
3,0 |
|
Нитраты металлов |
Ce(NO3)3·6H2O |
Cu(NO3)2·3H2O |
|
Молярная масса, г/моль |
434,22 |
241,59 |
|
Температура разложения, °C |
<200 |
<170 |
|
Растворимость в воде, г/мл |
3,81 |
1,25 |
Примечание. * – измерено для водно-спиртовой смеси (H2O/C2H5OH = 50/50).
В качестве инициирующих добавок были взяты кристаллогидраты нитратов переходных металлов: Ce(NO3)3·6H2O и Cu(NO3)2·3H2O. Краткая характеристика исходных соединений также представлена в таблице.
Для нанесения инициирующих добавок был выбран метод пропитки по влагоёмкости [11]. Для пропитки был использован водно-спиртовой раствор с объёмным соотношением C2H5OH/H2O = 50/50, что позволило преодолеть гидрофобность исходных углей. Влагоёмкость высушенных образцов углей (в мл/г) определялась непосредственно перед нанесением пропиточного раствора (таблица). Затем приготовленный раствор наносился на ранее подготовленные порошки угля с помощью механического дозатора. Пропитанные порошки угля выдерживались в сушильном шкафу при температуре 105 °С в течение 20 часов. Массовая доля добавок в модифицированных образцах (в пересчёте на сухую соль) составляла 5 %.
Исследование процесса горения модифицированных образцов углей проводилось с помощью синхронного термического анализатора STA 449 C Jupiter (Netzsch, Germany). Все эксперименты осуществлялись при скорости нагрева 2,5 °С/мин в корундовом тигле с перфорированной крышкой в интервале температур 45–600 °С. Образец массой 7 мг помещался в поток смеси воздуха (60 мл/мин) и азота (10 мл/мин). Все эксперименты проводились в условиях атмосферного давления.
Для серии образцов УБ-1 было выполнено качественное определение состава газообразных продуктов окисления на выходе из термического анализатора. Анализ проводился с помощью сопрягаемого квадрупольного масс-спектрометра QMS 403 D Aeolos (Netzsch, Germany).
Характеристики процесса окисления модифицированных углей определялись с помощью графического метода, подробное описание которого представлено в нашей предыдущей работе [12].
Результаты исследования и их обсуждение
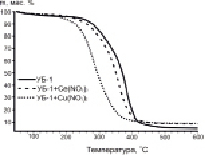
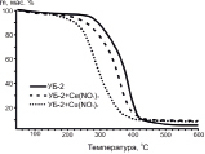
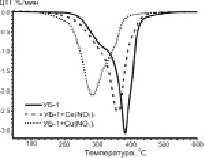
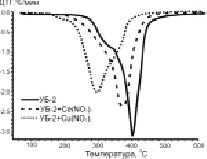
Результаты исследования процесса окисления образцов методом ТГА представлены на рис. 1.
А Б
Рис. 1. ТГ и ДТГ-кривые процесса окисления исследуемых образцов углей. А – образцы серии УБ-1; Б – образцы серии УБ-2
Сопоставляя полученные результаты (рис. 1), можно отметить, что исходные образцы бурых углей, УБ-1 и УБ-2, имеют схожий характер разложения и близкую температуру зажигания (Ti): 260 °С и 280 °С соответственно. Параметр Tf (момент полного разложения образца) для образцов сравнения также различается на 20 градусов: 500 °С (УБ-1) и 520 °С (УБ-2). Разница в значениях Ti и Tf возникает в результате небольшого различия в содержании летучих веществ и углерода в составе исходных образцов УБ-1 и УБ-2 (таблица).
Анализ ДТГ-профилей (рис. 1) позволяет выделить четыре стадии изменения массы образца: потеря влаги (до 100 °С); термическая деструкция частиц с выделением летучих соединений (100–260 °С); окисление летучих соединений после их возгонки (260–360 °C) и разложение коксового остатка (в интервале 360–520 °С). Из данных на рис. 1 видно, что потеря массы образцов на 1-ой стадии процесса не превышает 2 %, что объясняется использованием в эксперименте предварительно высушенных образцов. Как было сказано выше, в ходе второй стадии осуществляется эндотермический процесс деструкции бурого угля, который завершается воспламенением летучих веществ (стадия 3). Процесс горения сопровождается дальнейшей внутренней деструкцией частиц, что облегчает высвобождение летучих соединений из объёма. Таким образом, в результате протекания стадий 1–3 происходит существенное изменение структуры реагирующей части топлива с расширением внутренних трещин и пор, что приводит к интенсификации взаимодействия поверхности с окислительной средой.
Отметим, что на ДТГ-кривых модифицированных образцов углей невозможно выделить переход между 3-й и 4-й стадиями, поскольку окисление образующегося коксового остатка происходит параллельно с догоранием освобождающихся летучих компонентов (рис. 1).
Что касается модифицированных образцов (рис. 1), активная потеря массы для них наблюдается в температурной области 190–210 °С, что связано с разложением нанесённых нитратов металлов (таблица). Разложение нитратов на поверхности частиц угля способствует значительному сдвигу температуры зажигания в низкотемпературную область. При этом наибольшее изменение параметра Ti наблюдается для образцов, содержащих 5 мас. % Cu(NO3)2, тогда как минимальный эффект зафиксирован для нитрата церия.
В целом протекание процесса окисления имеет схожий характер для обеих серий образцов. При этом для всех модифицированных образцов на первых этапах реакции, вместе со снижением температуры зажигания, отмечается увеличение скорости реакции (рис. 1). В то же время для углей с добавкой Ce(NO3)3 при дальнейшем увеличении температуры скорость потери массы замедляется, и характер кривых становится аналогичным образцам сравнения.
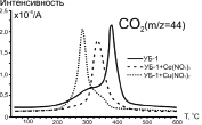
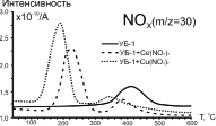
На рис. 2 приведены масс-спектрометрические профили, соответствующие основным продуктам окисления (СО2 (m/z = 44) и NOx (m/z = 30)) на примере образцов серии УБ-1.
А Б
Рис. 2. МС-профили выделения CO2 (А) и NOx (Б) в составе продуктов окисления серии образцов УБ-1
Выделение диоксида углерода (m/z = 44) – основного продукта окисления горючего вещества – характеризуется бимодальной кривой для образца, не содержащего добавок (УБ-1). Первый максимум (320 °С) связан с окислением десорбирующихся летучих веществ, а второй (380 °С) – с последующим окислением коксового остатка. Введение промотирующих добавок приводит к снижению температуры возгонки и воспламенения летучих веществ, и концентрационные кривые для CO2 принимают мономодальный вид. Наибольший сдвиг максимума по температуре наблюдается для образца модифицированного добавкой нитрата меди (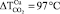 ). Для образцов содержащих Ce(NO3)3 данная величина составляет
). Для образцов содержащих Ce(NO3)3 данная величина составляет 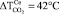 .
.
На рис. 2, Б, сопоставлены масс-спектрометрические данные по оксидам азота NOx (m/z = 30) для разных добавок. Видно, что нанесение нитратов церия и меди приводит к существенным изменениям МС-профиля. В первую очередь следует отметить появление интенсивного широкого пика в низкотемпературной области (190–223 °C) для всех модифицированных образцов, что очевидно связано с деструкцией нанесённых нитратов (рис. 2). Характер выделения NOx свидетельствует о том, что разложение Cu(NO3)2 начинается уже при ~130 °C, что позволяет предположить определённую степень участия носителя (угля) в данном процессе.
Вторая, менее интенсивная, волна выделения NOx имеет отношение к образованию оксидов азота в режиме пламени за счёт вовлечения молекулярного азота N2 в процесс окисления (рис. 2). Следует подчеркнуть, что в данном случае также имеет место смещение второго пика 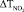 в область меньших температур (410>340 °С), величина которого зависит от природы промотирующей добавки. Важно, что данный процесс сопровождается заметным уменьшением интенсивности образования NOx, что следует из сопоставления данных на рис. 2, Б.
в область меньших температур (410>340 °С), величина которого зависит от природы промотирующей добавки. Важно, что данный процесс сопровождается заметным уменьшением интенсивности образования NOx, что следует из сопоставления данных на рис. 2, Б.
Таким образом, оксиды азота NOx, образующиеся в результате разложения нанесённых нитратов, способствуют значительному ускорению процесса окисления углей, инициируя раннюю возгонку летучих соединений и их последующее зажигание. Сопоставление результатов ДТГ и МС-анализа (рис. 2) позволяет заключить, что сдвиг температуры зажигания ΔТi находится в прямой корреляции с температурой разложения соответствующих нитратов металлов.
Рассматривая возможный механизм действия инициирующей добавки (на примере Cu(NO3)2) на процесс окисления углей, следует упомянуть ряд ключевых уравнений реакций:
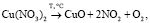 (1)
(1)
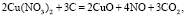 (2)
(2)
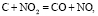 (3)
(3)
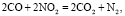 (4)
(4)
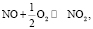 (5)
(5)
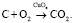 (6)
(6)
Во-первых, нагревание нитрата меди (до 170 °С и выше) способствует его разложению по уравнению (1). В то же время, согласно данным МС-анализа, разложение нанесенной соли Cu(NO3)2 начинается при более низкой температуре (130 °С), что позволяет предположить участие углерода в данном процессе в качестве восстановителя (уравнение (2)). В результате разложения нитрата образуются оксиды азота NO и NO2, последний из которых выступает в роли сильного окислителя, промотирующего процесс горения углерода и летучих соединений (уравнения (3) и (4)). Взаимодействие угля с диоксидом азота сопровождается образованием NO, который легко окисляется кислородом воздуха в соответствии с обратимой реакцией (5).
По завершению процесса разложения Cu(NO3)2 образуется дисперсный нестехиометрический оксид меди CuOx, равномерно распределённый в структуре образца. Высокая каталитическая активность оксида меди для процессов полного окисления органических субстратов и топлива хорошо известна [4], что позволяет рассматривать дальнейшее участие образующихся частиц CuOx в качестве катализатора, ускоряющего процесс окисления бурого угля (уравнение (6)).
Заключение
В работе исследовано инициирующее действие нитратов церия и меди на реакционную способность бурых углей. Результаты исследования процесса окисления образцов методом ТГА позволили определить следующий порядок «активности» инициирующих добавок: Ce(NO3)3 < Cu(NO3)2.
Анализ характеристик процесса окисления показал, что использование инициирующих добавок способствует снижению температуры зажигания Ti на 20–55 °C и уменьшению времени полного окисления образца tf .
Было установлено, что использование нитратов металлов в качестве инициирующих добавок способствует снижению барьера реакций окисления и термической деструкции, что в конечном итоге приводит к значительному ускорению процесса горения в целом и его смещению в низкотемпературную область.
Выявленные закономерности инициируемого окисления бурого угля в присутствии нитратов металлов могут быть в дальнейшем использованы при разработке более эффективных методов сжигания твёрдого топлива.
Библиографическая ссылка
Ларионов К.Б., Громов А.А. ИЗМЕНЕНИЕ РЕАКЦИОННОЙ СПОСОБНОСТИ БУРЫХ УГЛЕЙ ПУТЕМ ИНТЕГРИРОВАНИЯ ИНИЦИИРУЮЩИХ ДОБАВОК CE(NO3)3 И CU(NO3)2 // Современные наукоемкие технологии. 2018. № 3. С. 73-78;URL: https://top-technologies.ru/ru/article/view?id=36939 (дата обращения: 04.02.2026).



