Природные воды представляют собой сложные растворы различных веществ. Они содержат различные загрязнители как естественного, так и искусственного происхождения. В настоящее время природные воды загрязняются промышленными стоками, что создает серьезную проблему и ухудшает экологическую обстановку. Очистка таких вод осуществляется разными методами, как правило, комплексными, что повышает затраты. Высокие цены очистки природных вод требуют поиска более дешевых и эффективных сорбентов [1–3].
На территории Тюменской области находятся большие запасы глинистых минералов. Глины широко используются для производства кирпича, огнеупоров, а также в качестве сорбентов. Одним из перспективных глинистых материалов является каолинит – это главное составляющее всех глин [4]. Основа его – это водные кристаллогидратные алюмосиликаты Al4[Si4O10][OH]8 с небольшими примесями железа (III), магния, кальция, натрия, калия.
Целью настоящей работы являлось исследование адсорбционных свойств каолинита при извлечении ионов кобальта из нитратных водных растворов.
Материалы и методы исследования
Природный сорбент каолинит представляет собой легкий порошок белого цвета с размерами частиц 2–20 мкм и насыпной плотностью 0,3 г/см3. На рис. 1 представлена СЭМ-микрофотография образца сорбента, полученная на сканирующем электронном микроскопе. По полученным данным основными его компонентами являются оксиды в количествах, представленных в табл. 1.

Рис. 1. СЭМ-микрофотография каолинита
Таблица 1
Содержание компонентов в составе каолинита
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
|
% мас. |
43,98 |
18,73 |
0,96 |
0,80 |
0,06 |
6,32 |
|
Число молей |
0,732 |
0,180 |
0,015 |
0,007 |
0,009 |
0,057 |
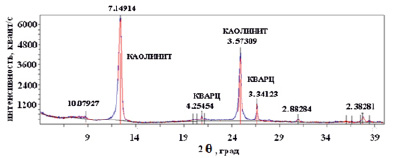
Рис. 2. Рентгенограмма образца каолинита
Атомное отношение алюминия к кремнию по представленным данным составляет ~ 1/2,4, что соответствует максимальному числу и силе кислотных центров поверхности алюмосиликатного каркаса каолинитовой глины [5]. Активными центрами являются подвижные ионы Na+ и K+, принимающие участие в обмене на ионы тяжелых металлов.
Минералогический состав каолинита определяли рентгенофазовым анализом. На рис. 2 представлена рентгенограмма, снятая на дифрактометре «ДРОН-7» с медным анодом (λ = 1,5406 A).
Результаты рентгенофазового анализа дают дополнительные основания для предположения о высокой подвижности и обменной способности катионов Na+ и K+, удерживаемых на поверхности каолинита.
Адсорбцию ионов кобальта (II) на каолините изучали в статических условиях из нитратных растворов с концентрациями от 0,01 до 0,24 ммоль/мл. Изотермы адсорбции получали методом переменных концентраций. Сорбент в количестве 1 г заливали 50 мл раствора. Контакт сорбента с раствором продолжался до установления равновесия в течение 7 суток. Затем сорбент и раствор отделяли и анализировали на содержание ионов кобальта и измеряли рН среды с помощью рН-метра «Анион» (Россия). Концентрацию ионов кобальта в растворе определяли обратным титрованием сульфатом магния в присутствии индикатора эриохрома черного [6]. Количество вещества, адсорбированного единицей массы каолинита, рассчитывали по формуле [7]
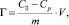
где C0 – концентрация кобальта в исходном растворе, ммоль/мл; Cp – равновесная (остаточная) концентрация извлекаемого иона в растворе, ммоль/мл; V – объем раствора, мл; m – масса сорбента, г.
По полученным данным строили изотермы адсорбции.
Результаты исследования и их обсуждение
При образовании исходных растворов нитратов кобальта возможно протекание гидратообразования с выделением плохо растворимого гидроксида Co(OH)2, а также гидролиз катионов кобальта. Оба эффекта способны оказывать влияние на результаты адсорбции. В 1М растворах начальная величина водородного показателя среды при начале гидратообразования pHгидр. для Со2+ равна 6,6 [8], в случае 0,01М растворов Со2+ соответственно 7,6 [8], а при полном осаждении, где автор принимает концентрацию 10–5 М, pHгидр. составляет 9,2 [8]. В связи со снижением в процессе адсорбции концентраций Со2+, гидролизующегося по уравнению [7]
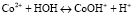 , (1)
, (1)
происходит непрерывное изменение водородного показателя среды (рис. 3). Величина рН может быть рассчитана из зависимости (KW ионное произведение воды принято равным 10–14)
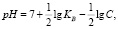 (2)
(2)
где KB – константа основности гидроксида кобальта (по второй ступени гидролиза) равная 4,0•10–5 [7] и С – концентрация гидролизующих ионов, моль/л [7]. Результаты изменения рН растворов представлены на рис. 3, из которых следует, что по мере снижения содержания ионов кобальта рН раствора возрастает.
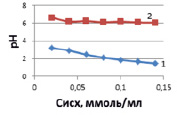
а)
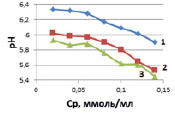
б)
Рис. 3. Влияние концентрации ионов кобальта на величину рН растворов солей расчетных (1), исходных (2) (а) и после адсорбции (б) при температурах, К: 298 (1), 313 (2), 333 (3)
Закономерности адсорбции ионов кобальта на каолините изучали путем влияния концентрации исходного раствора и температуры на величину адсорбции. В результате установили, что с увеличением концентрации ионов кобальта в исходном растворе возрастает величина удельной адсорбции.
Полученные данные показывают, что адсорбционная емкость при температуре 298 К составляет 0,20 ммоль/г; при 318 К – 0,41 ммоль/г и при 333 К – 0,54 ммоль/г. Таким образом, адсорбционная емкость возрастает с ростом температуры.
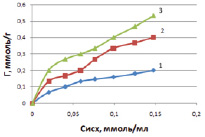
Рис. 4. Зависимость величины адсорбции ионов кобальта от исходной концентрации на каолините при температурах, К: 298 (1); 313 (2); 333 (3)
В результате адсорбции наблюдается конкуренция двух видов межмолекулярных взаимодействий: гидратация ионов металлов и взаимодействие ионов металлов с сорбентом [9]. С увеличением концентрации ионов в растворе адсорбция на каолините возрастает и в области 0,05 ммоль/мл наблюдается перегиб (рис. 4), указывающий на изменение механизма адсорбции. На первой ступени адсорбции ионов кобальта предельное значение ее не достигается, так как адсорбция протекает на разных активных центрах. Адсорбция проходит по ионообменному механизму по схеме [7]:
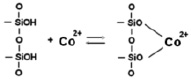
На второй ступени адсорбция проходит на менее доступных активных центрах на участках с более высокой степенью дисперсности.
Для описания адсорбционного процесса было использовано несколько моделей:
Ленгмюра:
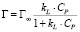
или
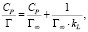
где Г – количество адсорбированного кобальта и Г∞ – величина предельной адсорбции (ммоль/г), Ср – равновесная концентрация ионов кобальта в растворе (ммоль/мл), kL – концентрационная константа адсорбционного равновесия, характеризующая интенсивность процесса адсорбции, мл/ммоль.
Модель изотермы Ленгмюра основана на том, что на поверхности катионита образуется мономолекулярный адсорбционный слой и все активные места обладают равной энергией и энтальпией сорбции [10].
Фрейндлиха:
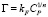
или в логарифмической форме
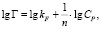
где kF и n – константы Фрейндлиха.
Модель Фрейндлиха используется для описания сорбции на гетерогенной поверхности [9]. Относительную адсорбционную способность отражает константа kF, а интенсивность сорбционного процесса и распределение активных центров характеризует константа n.
Темкина:
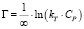
или
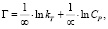
где kТ и ∞ – константы Темкина.
Модель Темкина содержит параметр kТ, который учитывает взаимодействие между адсорбционными центрами и ионами металлов. Кроме того, данная модель предполагает, что теплота адсорбции молекул в слое линейно уменьшается по мере заполнения слоя из-за отталкивания ионов металла. Снижение теплоты адсорбции происходит по линейному закону.
Линейная обработка изотерм адсорбции ионов кобальта из водных растворов на каолините представлена в табл. 2.
Таблица 2
Обработка изотерм адсорбции ионов кобальта (II) по моделям
|
Температура, К |
I ступень |
II ступень |
||||
|
Г∞, ммоль/г |
К, г/ммоль |
R2 |
Г∞, ммоль/г |
К, г/ммоль |
R2 |
|
|
Ленгмюра |
||||||
|
298 |
32,3 |
0,0031 |
0,925 |
4,07 |
0,07 |
0,975 |
|
313 |
111,1 |
0,0015 |
0,981 |
5,92 |
0,13 |
0,965 |
|
333 |
142,9 |
0,0019 |
0,968 |
7,30 |
0,15 |
0,939 |
|
Фрейндлиха |
||||||
|
lgkF |
1/n |
R2 |
lgkF |
1/n |
R2 |
|
|
298 |
0,007 |
0,69 |
0,998 |
0,368 |
0,41 |
0,999 |
|
313 |
0,005 |
0,52 |
0,996 |
0,235 |
0,72 |
0,998 |
|
333 |
0,003 |
0,39 |
0,999 |
0,349 |
0,72 |
0,999 |
|
Темкина |
||||||
|
lgkT |
1/n |
R2 |
lgkT |
1/α |
R2 |
|
|
298 |
0,034 |
0,003 |
1,0 |
0,282 |
0,161 |
0,984 |
|
313 |
0,025 |
0,002 |
1,0 |
0,291 |
0,177 |
0,966 |
|
333 |
0,010 |
0,011 |
1,0 |
0,330 |
0,178 |
0,958 |
Результаты табл. 2 показывают, что при адсорбции ионов кобальта на каолините предельная адсорбция Г∞ равна 36,37 ммоль/г, а константа адсорбционного равновесия К, равная 0,0031 мл/ммоль (298 К), характеризует энергию взаимодействия ионов кобальта с поверхностью сорбента.
Значение константы n в уравнении Фрейндлиха (n > 1) свидетельствует о благоприятных условиях адсорбции ионов кобальта по первой ступени, энергия связи между сорбентом и ионами кобальта уменьшается по мере заполнения поверхности. На второй ступени адсорбция протекает на менее доступных активных центрах.
Значения второй константы Фрейндлиха kF указывают на легкость перехода ионов кобальта из раствора в фазу сорбента и на адсорбционную способность по отношению к ионам кобальта.
Коэффициент kТ в модели Темкина учитывает взаимодействия между адсорбционными центрами и ионами кобальта.
Заключение
На основании приведенных исследований и полученных результатов можно сделать следующие выводы.
Изотермы сорбции ионов кобальта на каолините обработаны моделями изотерм адсорбции Ленгмюра, Фрейндлиха, Темкина.
Установлено, что сорбция ионов кобальта из разбавленных растворов лучше описывается моделью Фрейндлиха.
Определены значения предельной статической адсорбционной емкости каолинита, которая составляет 36,37 ммоль/г, вычислены коэффициенты распределения, значения которых уменьшаются с увеличением концентрации ионов кобальта в растворе.
Полученные значения обменной емкости каолинита по отношению к ионам кобальта близки к ионообменным катионитам, что позволяет предположить использование каолинита для очистки природных и сточных вод от тяжелых металлов, в частности от ионов кобальта.
Библиографическая ссылка
Пимнева Л.А. ИССЛЕДОВАНИЕ АДСОРБЦИИ ИОНОВ КОБАЛЬТА (II) КАОЛИНИТОМ // Современные наукоемкие технологии. 2017. № 7. С. 61-65;URL: https://top-technologies.ru/ru/article/view?id=36730 (дата обращения: 05.03.2026).



