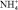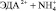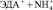Этилендиамин (ЭДА) находит применение в нефтехимической промышленности, в производстве красителей, эмульгаторов, стабилизаторов латексов, антиокислительных присадок к моторным маслам, пластификаторов, фунгицидов и других материалов [9].
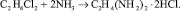
В промышленности ЭДА в основном получают аммонолизом 1,2-дихлорэтана. Продуктом замещения атомов хлора на аминогруппы является промежуточное соединение – дигидрохлорид этилендиамина (ДГХ ЭДА):
Реакцию аминирования дихлорэтана проводят 20–70 % водным раствором аммиака при температуре до 180 °С, давлении 0,8–7 МПа и мольном отношении дихлорэтана и аммиака 1:2–6,4 [4, 7].
Для выделения этилендиамина ДХГ ЭДА обрабатывают щелочью:
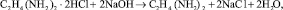
после чего подвергают выпариванию и ректификации [5]. В процессе выпаривания получают газообразный аммиак, направляемый на стадию аминирования 1,2-дихлорэтана, амины, направляемые на ректификацию для их выделения, и насыщенный раствор поваренной соли с содержанием 1–2 % аминов. В процессе ректификации в верхней части ректификационной колонны образуется водная фракция с содержанием около 1 % этилендиамина и около 2 % аммиака. Таким образом, сточные воды, образующиеся в производстве ЭДА, представляют собой насыщенный раствор поваренной соли с примесью аминов и водную фракцию процесса ректификации, содержащую ЭДА и аммиак. В расчете на 1 т ЭДА образуется около 3 м3 насыщенного раствора поваренной соли и около 14 м3 водной фракции процесса ректификации. Поскольку содержание аминов и аммиака в этих стоках значительно превышает их предельно допустимые концентрации, то перед сбросом их подвергают многократному разбавлению.
Ранее авторами был исследован процесс переработки ДГХ ЭДА в электролизерах с ионообменными мембранами. Было показано, что можно заменить разрушение ДГХ ЭДА щелочью на его электрохимическую переработку. В этом случае, можно значительно уменьшить потребление щелочи для разрушения ДХГ ЭДА или полностью исключить ее из технологического цикла [1–3, 6, 8].
В настоящей работе приводятся результаты, полученные при изучении процесса переработки легкой фракции, образующихся на стадии ректификации и представляющей собой воду, содержащую ЭДА и аммиак.
Материалы и методы исследований
Лабораторные исследования проводились на установке, представленной на рисунке.
Электролизер был разделен на 3 камеры катионообменной К и анионообменной А мембранами с рабочей поверхностью 38,5 см2 каждая. В качестве катионообменной мембраны применялась мембрана марки МК-40, а в качестве анионообменной – мембрана марки МА-40. Через катодную камеру электролизера циркулировал 0,1 н раствор NaOH, а в анодной – сточная вода. На катоде происходило разложение воды с выделением водорода и генерацией ионов OH–. На аноде разложение воды сопровождалось выделением кислорода и образованием в растворе ионов H+. Ионы OH– через анионообменную мембрану мигрировали в среднюю камеру электролизера. Дальнейшему продвижению их к аноду препятствовала катионообменная мембрана. Ионы 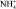 и ЭДА+ через катионообменную мембрану мигрировали в среднюю камеру электролизера и концентрировались в ней. Таким образом, в средней камере электролизера происходило накопление концентрата, содержащего аммиак и этилендиамин. Концентрат из средней камеры по мере образования поступал в емкость.
и ЭДА+ через катионообменную мембрану мигрировали в среднюю камеру электролизера и концентрировались в ней. Таким образом, в средней камере электролизера происходило накопление концентрата, содержащего аммиак и этилендиамин. Концентрат из средней камеры по мере образования поступал в емкость.
Лабораторные исследования проводились с модельным раствором сточной воды, содержащей 10,1 г/л ЭДА и 19,2 г/л аммиака. Концентрацию ЭДА и аммиака определяли потенциометрическим титрованием с соляной кислотой.
Схема лабораторной установки: 1 – электролизер; 2, 4, 6 – емкости; 3, 5 – насосы
Для исследования распределения ЭДА и NH3 по камерам электролизера была поставлена серия опытов, в которых в анодной камере электролизера циркулировал раствор сточной воды объемом 200 мл, в катодной камере циркулировал 0,1 н раствор гидроксида натрия объемом 200 мл, а в среднюю камеру заливалась дистиллированная вода. Таким образом, весь этилендиамин и аммиак в начале процесса циркулировал только в анодной камере. Начальное количество ЭДА и NH3 составляло 2,02 г (0,0337 моль) и 3,84 г (0,226 моль) соответственно. Количество электричества, пропущенного через аппарат во всех опытах оставалось постоянным и составляло 1 А•ч. После пропускания через электролизер указанного количества электричества растворы, циркулировавшие в камерах аппарата, количественно собирались и анализировались на содержание этилендиамина и аммиака.
Для определения максимальной концентрации этилендиамина и аммиака в растворе, образующемся в средней камере электролизера, была поставлена серия опытов, в которой через анодную камеру циркулировал раствор этилендиамина и аммиака (сточная вода) объемом 1 л. Через катодную камеру циркулировал 0,1 н раствор гидроокиси натрия объемом 1 л. Раствор этилендиамина и аммиака, концентрируемый в средней камере аппарата, по мере накопления собирался в емкости. Через каждые 0,5 часа раствор, генерируемый в средней камере, анализировался на содержание этилендиамина и аммиака. Процесс электролиза продолжался до тех пор, пока концентрация веществ в растворе, образующемся в средней камере, не становилась постоянной.
Результаты исследования и их обсуждение
Экспериментальные результаты по распределению ЭДА и NH3 в камерах аппарата представлены в табл. 1.
Наличие ЭДА и NH3 в катодной камере электролизера обнаружено не было. Это указывает на то, что в результате протекания электрического тока в аппарате происходит перенос этилендиамина и аммиака из анодной камеры только в среднюю камеру электролизера. Анионообменная мембрана марки МА-40 полностью исключает перенос ионов ЭДА и аммиака по направлению к катоду. Невязка материального баланса (разность начального и конечного содержания компонента, отнесенная к его начальному содержанию в аппарате) различна для этилендиамина и аммиака. В случае ЭДА невязка материального баланса не превышает 2,5 %, что соответствует погрешности эксперимента.
В случае NH3 невязка материального баланса достигает 7,8 %. Следует отметить, что для всех опытов суммарное количество аммиака, обнаруженное в электролизере после опыта, меньше, чем его начальное количество. Такое поведение NH3 объясняется его повышенной летучестью в условиях, которые реализуются в аппарате.
Зависимость количества ЭДА и NH3, перенесенных в среднюю камеру электролизера, от плотности тока отсутствует. В связи с этим для анализа затрат электричества на процесс концентрирования ЭДА и аммиака в средней камере электролизера и расчета выхода по току использовали средние значения масс ЭДА и NH3, перенесенных в среднюю камеру электролизера. При этом рассматривали возможность существования в воде ионов ЭДА+ 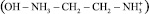 и ЭДА2+
и ЭДА2+ 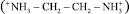 . Затраты электричества и выход по току представлены в табл. 2.
. Затраты электричества и выход по току представлены в табл. 2.
Таблица 1
Распределение этилендиамина и аммиака по камерам электролизера
|
Плотность тока, А/м2 |
Масса ЭДА в камерах, г |
Масса NH3 в камерах, г |
Невязка материального баланса, % |
|||||
|
анодная |
средняя |
сумма |
анодная |
средняя |
сумма |
ЭДА |
NH3 |
|
|
65 |
1,11 |
0,90 |
2,01 |
3,19 |
0,35 |
3,54 |
0,5 |
7,8 |
|
130 |
1,06 |
0,92 |
1,98 |
3,21 |
0,34 |
3,55 |
2,0 |
7,6 |
|
195 |
1,04 |
0,94 |
1,98 |
3,18 |
0,36 |
3,54 |
2,0 |
7,8 |
|
260 |
1,09 |
0,93 |
2,02 |
3,20 |
0,40 |
3,60 |
0 |
6,3 |
|
389 |
1,11 |
0,90 |
2,01 |
3,19 |
0,38 |
3,57 |
0,5 |
7,0 |
|
519 |
1,06 |
0,91 |
1,97 |
3,21 |
0,38 |
3,59 |
2,5 |
6,5 |
Таблица 2
Затраты электричества и выход по току
|
Затраты электричества, А·ч |
Сумма затрат, А·ч |
Выход по току, % |
|||
|
ЭДА 2+ |
ЭДА+ |
|
|
|
|
|
0,819 |
0,410 |
0,580 |
1,399 |
0,990 |
99,0 |
Таблица 3
Максимальное содержание этилендиамина и аммиака в средней камере электролизера
|
Плотность тока, А/м2 |
130 |
195 |
260 |
389 |
519 |
|
Концентрация ЭДА, г/л |
98,8 |
101,7 |
104,8 |
111,7 |
118,6 |
|
Концентрация NH3, г/л |
92,2 |
95,3 |
98,2 |
102,4 |
105,8 |
Анализ результатов показывает, что в случае переноса в среднюю камеру электролизера этилендиамина в виде ионов ЭДА2+ количество электричества, необходимое для этого, равно 0,819 А·ч. Если учесть количество электричества, необходимое для переноса ионов 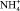 (0,580 А·ч), то суммарные затраты электричества должны составить 1,399 А·ч. Это намного больше количества электричества, пропущенного через электролизер в опыте. Расчет количества электричества на перенос ионов ЭДА+ и
(0,580 А·ч), то суммарные затраты электричества должны составить 1,399 А·ч. Это намного больше количества электричества, пропущенного через электролизер в опыте. Расчет количества электричества на перенос ионов ЭДА+ и 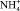 с большой точностью совпадает с количеством электричества, пропущенным через электролизер в опыте. Это указывает на то, что в водном растворе этилендиамин находится в виде иона ЭДА+. Выход по току, рассчитанный по переносу в среднюю камеру ионов ЭДА+ и
с большой точностью совпадает с количеством электричества, пропущенным через электролизер в опыте. Это указывает на то, что в водном растворе этилендиамин находится в виде иона ЭДА+. Выход по току, рассчитанный по переносу в среднюю камеру ионов ЭДА+ и 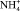 , составил 99,0 %.
, составил 99,0 %.
Максимальное содержание этилендиамина и аммиака в растворе, образующемся в средней камере электролизера, представлено в табл. 3.
Максимальная концентрация этилендиамина и аммиака в растворе, образующемся в средней камере электролизера, возрастает с увеличением плотности тока. Так при плотности тока равной 130 А/м2 концентрация этилендиамина в средней камере электролизера поднимается до 98,8 г/л, а концентрация аммиака – до 92,2 г/л. Увеличение плотности тока до 519 А/м2 приводит к повышению концентрации этилендиамина до 118,6 г/л и аммиака – до 105,8 г/л.
Заключение
По данным, представленным в литературе [4], для производства 1 т этилендиамина необходимо затратить около 2,7 м3 водного раствора аммиака с концентрацией примерно 50 %. Как было отмечено ранее, объем стока с верхней тарелки ректификационной колонны составляет около 14 м3. Очевидно, что использование этой сточной воды для приготовления раствора аммиака, используемого на стадии аминирования 1,2-дихлорэтана, невозможно из-за ее большого количества.
Электрохимическая переработка легкой фракции, образующейся на стадии ректификации и представляющей собой воду, содержащую ЭДА и аммиак, в мембранном электролизере позволяет получать концентрат, содержащий до 118 г/л этилендиамина и до 105 г/л аммиака. При этом объем концентрата, получаемого из 14 м3 сточной воды, составляет примерно 1,5 м3. Объем концентрата позволяет полностью использовать его для приготовления аммиачной воды, применяемой в процессе получения аминов. При этом исключается потеря этилендиамина и аммиака со сточными водами, а сточные воды можно сбрасывать в ХЗК без дополнительного разведения.
Библиографическая ссылка
Быковский Н.А., Кантор Е.А., Пучкова Л.Н., Фанакова Н.Н. ПЕРЕРАБОТКА ЛЕГКОЙ ФРАКЦИИ ПРОЦЕССА РЕКТИФИКАЦИИ В ПРОИЗВОДСТВЕ ЭТИЛЕНДИАМИНА // Современные наукоемкие технологии. 2016. № 6-2. С. 246-249;URL: https://top-technologies.ru/ru/article/view?id=36014 (дата обращения: 04.03.2026).