В двадцать первом веке особо актуальной становится проблема альтернативного, в том числе – возобновляемого, топлива. В качестве одного из перспективных экологичных видов топлива рассматривается водород. При электрохимической реакции, происходящей в топливных элементах, в качестве побочного материального продукта получается лишь вода. Основным промышленным источником водорода на сегодняшний день является ископаемое топливо, главным образом природный газ. Паровая конверсия метана, а затем образовавшегося монооксида углерода позволяет добиться высокого выхода водорода.
Однако водород, полученный таким путем, содержит остаточное количество CO (около 1 %), который является каталитическим ядом низкотемпературного топливного элемента. Для удаления этой примеси можно применять каталитическое селективное окисление монооксида углерода. В качестве активного компонента катализаторов предложено использовать платину, золото и медь. Катализаторы с добавлением меди (подложкой для них служит диоксид церия, CeO2) наиболее дешевы и демонстрируют высокую селективность и активность [7].
К недостатку CuO–CeO2 относится узкое «окно» одновременной высокой активности и селективности. Для минимальной потери водорода необходимо точно знать оптимальную температуру проведения процесса, которая зависит в том числе и от загрузки (содержания) меди. Для корректного предсказания селективности и выбора оптимальной температуры необходимо глубокое понимание механизма окисления монооксида углерода и H2, чему посвящено много работ.
Для окисления CO на CuO–CeO2 катализаторе в 1995 году Lui и Plytzani-Stephanopoulos [6] предложили механизм с адсорбцией CO на активных центрах, стабилизированных в состоянии Cu+ (назовем их медными). Кислород в этом механизме адсорбируется на других активных центрах (диоксида церия) и быстро мигрирует по поверхности диоксида церия до межфазной границы, где и происходит реакция. Стабилизацию Cu+ и отсутствие значимого переокисления до Cu2+ предполагали и другие авторы [4–5].
Окислительно-восстановительный механизм был предложен несколькими годами позднее группой проф. Martinez-Arias [7]. В этом механизме подчеркивалась роль межфазной границы Cu/CeO2, и постулировалось восстановление Cu2+ –O2– –Ce4+ до Cu+ –V–Ce 3+ за счет CO и обратное переокисление активных центров за счет адсорбируемого на межфазной границе кислорода (V означает кислородную вакансию). В 2010 году Moreno и др. [9] сообщили, что окислительно-восстановительный механизм окисления CO с циклическим изменением степени окисления меди между Cu+ и Cu2+ [7] лучше описывает экспериментальные данные, чем механизм Lui и Plytzani-Stephanopoulos [6].
Однако, несмотря на исследования [9], остается невыясненным источник кислорода для окисления CO: Moreno и др. [9] предполагали, что в передаче кислорода к медным активным центрам принимает участие вся поверхность диоксида церия (рис. 1, а), в то время как в [4] называли вероятным механизмом непосредственную диссоциацию O2 на медных активных центрах (рис. 1, б), а Kydd и др. [5] рассматривали оба механизма как возможные.
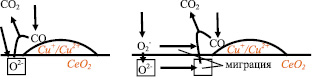
а б
Рис. 1. Варианты механизма поступления кислорода при окислении CO на CuO–CeO2 катализаторе: а – адсорбция и диссоциация непосредственно на медных активных центрах; б – миграция кислорода по поверхности или через решетку CeO2 к медным активным центрам. Квадратом обозначена кислородная вакансия в решетке CeO2
Таким образом, установление механизма поступления кислорода при окислении CO на CuO–CeO2 катализаторе является открытой задачей.
Окисление водорода для CuO–CeO2, скорее всего, происходит на тех же частицах, что и CO [5]. Поэтому механизм окисления CO тесно связан и с механизмом окисления водорода. При этом все исследователи соглашаются в том, что Cu + восстанавливается водородом до Cu0 [4–5].
Целью данной работы было уточнение кинетического механизма окисления монооксида углерода и водорода на CuO–CeO2, а именно выявление источника кислорода и определение роли подложки CeO2 методом математического и компьютерного моделирования. Для этой цели помимо данных по каталитическому окислению CO в данной работе были использованы данные по селективному окислению CO в смеси с H2.
Также в работе показано, как, используя полученные результаты и знания кинетического механизма, можно установить оптимальное содержание меди в катализаторе для достижения максимальной селективности. Это обуславливает практическую значимость полученных результатов.
Материалы и методы исследования
Микрокинетическое моделирование выполняется на основе детальной кинетической схемы, состоящей из элементарных и квазиэлементарных стадий:
 ρ = 1, K, Nρ, (1)
ρ = 1, K, Nρ, (1)
где Ai – обозначение газофазной или поверхностной частицы; 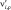 ,
, 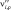 – стехиометрические коэффициенты для реагентов и продуктов ρ-й обратимой стадии соответственно, где ρ = 1 ,…, Nρ; Nsp – число различных типов частиц; Nρ – число обратимых стадий, включающих в себя прямую (индекс f, ρ) и обратную (индекс b, ρ) стадии.
– стехиометрические коэффициенты для реагентов и продуктов ρ-й обратимой стадии соответственно, где ρ = 1 ,…, Nρ; Nsp – число различных типов частиц; Nρ – число обратимых стадий, включающих в себя прямую (индекс f, ρ) и обратную (индекс b, ρ) стадии.
Для расчета скоростей отдельных стадий используется уравнение Аррениуса, на основе этих скоростей рассчитываются мольные скорости превращения газофазных веществ Ri,mol. Для поверхностных частиц j используется стационарное приближение, Ri,mol = 0. Для стадий адсорбции предэкспоненциальный множитель записан как коэффициент вероятности адсорбции [1]. Состояние каталитической поверхности определяется степенью покрытия поверхности θj для каждого адсорбированного вещества, где
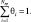
Процесс окисления CO на CuO–CeO2 катализаторе производится при температурах до 270 °C. При этом в газовой фазе процесс окисления CO и водорода не происходит, поэтому кинетическая схема состоит только из поверхностных реакций.
Термодинамическая непротиворечивость кинетических параметров, то есть соблюдение условия детального баланса при равновесии, обеспечивается применением специального алгоритма модификации кинетических параметров [1–2], при этом отдельно производится согласование параметров для получения непротиворечивых значений энтальпии и энтропии реакции. Подбор кинетических параметров осуществляется в разработанном ранее авторами программном пакете mech_optimiz [8] путем многократного запуска процедуры оптимизационного поиска. Поиск выполняется с учетом диапазонов поиска для каждого параметра, получаемых из предварительно заполняемой пользователем по литературным данным базы данных реакций. Для каждого варианта кинетического механизма осуществляется 40–60 запусков процедуры поиска и выбирается наилучший набор кинетических параметров, который и участвует в итоговом сравнении.
Математическая модель состоит из системы одномерных уравнений изменения мольных расходов Fi для компонентов газовой смеси i (ячеечная модель реактора):
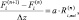 (2)
(2)
где Δz – шаг по продольной координате реактора, м; n – номер шага, или ячейки реактора; a – коэффициент, м2/м3, рассчитывается как отношение полной поверхности катализатора и объема реактора.
Используемые литературные данные [3] содержат информацию о конверсии реагентов при низкотемпературном окислении CO в отсутствии водорода и селективном окислении CO в присутствии 50 % H2 на катализаторах, содержащих 2,8 и 8,7 мас. % Cu [3]. Число ячеек модели (2) вычислено из значения критерия Боденштейна и колебалось в пределах 3–7 ячеек идеального смешения (длина неподвижного слоя катализатора 7 мм, средний размер частиц 120 мкм). Эксперименты [3] проводились в изотермическом режиме, поэтому модель не учитывает изменение температуры. Доля поверхности, занятая активными медными центрами, получена из данных рентгеновской фотоэлектронной спектроскопии (РФЭС) с учетом данных температурно-программируемых экспериментов (ТПЭ) [3].
Отметим, что содержание активной мелкодисперсной меди на поверхности зависит от метода приготовления катализатора. В данном случае рассматривались катализаторы, приготовленные методом соосаждения по методике [3].
Результаты исследования и их обсуждение
На основе анализа публикаций было составлено два варианта кинетической схемы. Эти два варианта отражают различные предположения о роли поверхности диоксида церия в рассматриваемых реакциях каталитического окисления, или два варианта механизма реакции. Механизм с участием в адсорбции и транспорте кислорода всей поверхности диоксида церия (рис. 1, а) обозначен как CeOx + O2, в то время как механизм с диссоциацией O2 на медных активных центрах (рис. 1, б) обозначен Сux + O2.
Механизм окисления CeOx + O2 состоит из 9 обратимых реакций (таблица, реакции (1)–(9)).
Механизм Сux + O2 отличается тем, что вместо реакций (6)–(9) транспорта кислорода через подложку записываются реакции диссоциативной адсорбции кислорода на медных центрах 10–12. В обоих вариантах кинетического механизма стадия адсорбции кислорода записана как суммарная или сокращенная, то есть полагается, что переокисление центров адсорбции осуществляется быстро.
Взаимодействие с водородом состоит из стадий диссоциативной адсорбции водорода на 2 атомах меди, последующего восстановления меди до Cu0 или Cu+ с образованием H2O на поверхности и десорбции воды в газовую фазу. Было принято, что стадия восстановления происходит с участием того же механизма переноса кислорода, который предполагается для окисления CO. Заметим, что снятие этого допущения качественно не меняет результатов.
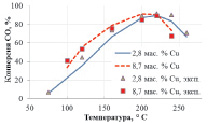
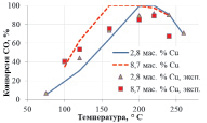
Механизм CeOx + O2 показывает лучшую сходимость с экспериментальными данными (рис. 2, а), чем Сux + O2 (рис. 2, б). Последний механизм не может объяснить селективность медноцерийоксидных катализаторов с различной загрузкой меди при селективном каталитическом окислении CO. Отметим, что данные по низкотемпературному превращению CO в отсутствии водорода не позволяют осуществить выбор между двумя моделями, что совпадает с выводом Moreno и др. [9].
Элементарные реакции при окислении CO на CuO–CeO2
|
№ п/п |
Реакция |
№ п/п |
Реакция |
№ п/п |
Реакция |
|
1 |
Cu2+ + CO |
5 |
Cu+ + CO |
9 |
2Ce2O3 + O2 ? 4 CeO2 |
|
2 |
Cu2+CO |
6 |
Cu+CO + 2 CeO2 |
10 |
2Cu+CO + O2 |
|
3 |
Cu+CO2 |
7 |
Cu+ + 2 CeO2 |
11 |
2Cu+ + O2 |
|
4 |
Cu+CO2 |
8 |
Cu0 + 2 CeO2 |
12 |
2Cu0 + O2 |
а б
Рис. 2. Конверсия CO при селективном окислении CO: а – механизм CeOx + O2; б – механизм Сux + O2. Экспериментальные данные [3] показаны точками, результаты моделирования – кривыми
Также мы исследовали зависимость селективности от содержания активного компонента в диапазоне 2–9 мас. % меди (рис. 3). При этом мы установили требование к степени очистки H2: содержание CO на выходе из реактора должно быть ниже 40 ppm. Также мы изменяли количество катализатора и исследовали, как изменялась селективность по CO и конверсия CO (рис. 3). Оказалось, что увеличение количества катализатора не только благотворно влияет на конверсию CO, но и позволяет добиться более высокой селективности за счет снижения температуры проведения процесса. По данным [4–5] превращение водорода начинается при T > 420 K. При увеличении количества катализатора до 2,5 г это значение снизилось до 370 K. Тем не менее использование 2,5 г катализатора уже при 350 K позволяет обеспечить близкую к 100 % конверсию CO (остаточная концентрация менее 40 ppm) для широкого спектра значений содержания меди в катализаторе (2,5–9 %). Максимальной селективности 99,8 % при этом удается достичь на наиболее активном в отношении CO катализаторе с содержанием 6,5 мас. % Cu. При этом оптимальная температура процесса равна 350 K.
Отметим, что если использовать 0,05–0,25 г катализатора, то требование по остаточному содержанию CO может быть удовлетворено только при температурах 373–433 K в зависимости от содержания меди, при этом потери водорода велики и максимальны также на самом активном катализаторе (с содержанием 6,5 мас. % Cu). Снижение температуры реакции и использование большего количества катализатора в данном случае намного эффективнее, чем попытка увеличить селективность изменением массового процента меди.
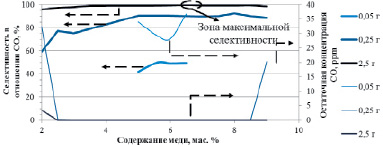
Рис. 3. Результаты моделирования максимально достижимой селективности в отношении CO в зависимости от массового содержания меди в катализаторе (диапазон 2–9 мас. % Cu) при варьируемом общем количестве катализатора (г). Максимальные значения селективности выбраны с тем условием, что остаточная концентрация CO на выходе из реактора (также приведена на рисунке) ниже 40 ppm
Выводы
В работе показано с помощью компьютерного микрокинетического моделирования, что окисление CO на CuO–CeO2 протекает с участием кислорода, адсорбированного на поверхность диоксида церия. Итак, CO и кислород не конкурируют за активные центры, и справедлив механизм с двумя типами активных центров (в зарубежной литературе, «dual-site mechanism» [9]): медными (мелкие частицы меди в тесном контакте с диоксидом церия принимают CO) и диоксида церия (принимают O2 и транспортируют его к медным центрам).
Для достижения максимальной селективности следует:
1) использовать пониженные температуры проведения процесса (< 370 K);
2) увеличивать общее количество загружаемого катализатора (например, при T = 350 K для 100 % конверсии CO требуется около 2,5 г катализатора, содержащего 2,5 или более мас. % Cu);
3) использовать наиболее активный катализатор (6,5 мас. % меди). Реализовать требования 1 и 2 одновременно можно, если эффективно рассеивать тепло реакции.
Для этого следует применять разбавление катализатора инертом и общее увеличение длины каталитического слоя.
Полученная микрокинетическая модель хорошо согласуется с данными экспериментов по конверсии и селективности CuO–CeO2 катализаторов и может быть использована для оптимизации конструкционных и технологических параметров проведения процесса низкотемпературного окисления CO и селективного каталитического окисления CO. В работе не рассматривалось ингибирование реакций окисления в присутствии CO2 и H2O, которые обычно присутствуют в потоке питания процесса селективного окисления CO. Эти вопросы будут освещены в отдельных работах.
Работа поддержана грантом РФФИ 14-07-00960.
Библиографическая ссылка
Митричев И.И., Женса А.В., Василенко В.А., Кольцова Э.М. РОЛЬ ПОВЕРХНОСТИ ДИОКСИДА ЦЕРИЯ В ПРОЦЕССЕ ОКИСЛЕНИЯ CO НА CUO–CEO2 КАТАЛИЗАТОРЕ: ВЫЧИСЛИТЕЛЬНОЕ ИССЛЕДОВАНИЕ // Современные наукоемкие технологии. 2016. № 6-1. С. 55-59;URL: https://top-technologies.ru/ru/article/view?id=35978 (дата обращения: 04.03.2026).




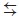 Cu
Cu