Сложные оксидные материалы со структурой шпинели отличаются сочетанием уникальных, иногда аномальных свойств. Научный интерес к изучению процессов фазообразования и свойств подобных материалов обусловлен, в первую очередь, их полифункциональными свойствами. Например, хромит кобальта (II) известен как ферримагнетик [7], катализатор окисления дихлорэтана [9], хромит никеля (II) применяют в качестве датчика ацетона [10], хромит меди (II) катализирует большую группу реакций в органической и неорганической химии [6, 8]. В течение последних десятилетий интерес к материалам подобного состава стимулируется развитием новой области исследований – получению материалов для спинтроники, магнетоэлектриков и т.д. Отличительной особенностью некоторых систем хромитов переходных элементов является наличие на фазовой диаграмме при комнатной температуре мультикритической точки, а также линий фазовых переходов второго рода [1]. Вблизи этих элементов фазовой диаграммы материалы обладают уникальными химическими и физическими свойствами. Поэтому изучение фазообразования и свойств в системе NiO-CoO-CuO-Cr2O3 представляет фундаментальный и практический интерес для химии и технологии неорганических катализаторов. Целью исследования являлось изучение процессов формирования структуры шпинелей в системе состава 0,6 NiCr2O4 – 0,2 CoCr2O4 – 0,2 CuCr2O4 и их каталитических свойств в процессах окислительной деструкции метилового оранжевого в присутствии пероксида водорода.
Материалы и методы исследования
Хромиты общего состава Ni0.6Co0.2Cu0.2Cr2O4 получали с использованием керамического метода с введением на стадии гомогенизации хлорида калия. Более подробно методика синтеза изложена в работах [2, 4, 5]. В качестве исходных веществ использовали оксиды никеля (II), кобальта (II), меди (II), хрома (III) марки хч. Исходные вещества гомогенизировали в агатовой ступке со спиртом на воздухе, брикетировали в таблетки диаметром 20 мм и подвергали термообработке при температуре 800–1000 °С. Фазовый состав изучали на рентгеновском дифрактометре ARL X’TRA (использовали Cu-Kα излучение). Уточнение структуры фаз, входящих в образцы, проводили по рефлексам 220, 311, 222, 422, 333, 440 для фазы кубической шпинели, 312 и 321 для фазы тетрагональной шпинели. Для анализа количественного соотношения между фазами использовали методику, описанную в [3]. Определение площади поверхности проводили на аппарате ChemiSorb 2750 В в ЦКП «Нанотехнологии» НИИ Нанотехнологий и новых материалов ЮРГПУ(НПИ).
Расчет среднего размера кристаллитов проводили по методу Шеррера по линии 311 по формуле
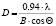 ,
,
где D – средний размер кристаллов, нм, λ – длина волны рентгеновского излучения, нм, B – значение ширины линии пика на половине его высоты, cos θ – значение косинуса угла для пика.
Изучение каталитической активности синтезированных материалов проводили на модельном растворе метилового оранжевого с концентацией 40 мг/л. При этом 10 мл исходного раствора метилового оранжевого помещали в плоскодонную колбу, добавляли 0,0012 г катализатора и 2 мл водного раствора пероксида водорода с концентрацией 3 % (масс.). Определение концентации метилового оранжевого в растворе проводили фотоколориметрическим методом через определенные интервалы времени. Расчет степени каталитической деструкции метилового оранжевого (Р), проводили по формуле
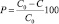 ,
,
где С0 – начальная концентрация раствора, мг/л; С – текущее значение концентрации раствора, мг/л.
Результаты исследования и их обсуждение
В системе NiO-CoO-CuO-Cr2O3 при синтезе материалов по приведенной методике формируются шпинелеподобные структуры (рис. 1). На рентгенограмме образца можно выделить линии, характеризующие фазы двух твердых растворов ориентировочного состава (CoNiCu)Cr2O4 со структурой кубической шпинели, их количество составляет ≈ 95 % и оксид хрома (III) (≈ 5 %).
Формирование структуры образца в заданных условиях приводит к выделению двух твердых растворов шпинельного типа – с кубической структурой приблизительного состава Co0.28Ni0.49Cu0.23Cr2O4 и тетрагональной Ni0.86Co0.02Cu0.12Cr2O4 [4]. Как известно [4], тетрагональное искажение структуры шпинели (c/a > 1) вызывает присутствие ян-теллеровского катиона Ni2+ в тетра-позициях в количестве не менее 85 мол. %. Поэтому формирующийся тетрагонально-искаженный твердый раствор будет содержать в составе 85–100 % Ni2+.
Формирование структуры образца может протекать по следующему механизму. На первом этапе формируется продукт реакции, содержащий все имеющиеся в системе катионы. Дальнейшие диффузионные процессы должны осложняться присутствием на поверхности продукта реакции. Кубический твердый раствор формируется на основе хромита никеля (II) с существенным содержанием хромита кобальта (II). В ходе повторных циклов термообработки присутствующие в составе твердого раствора катионы меди (в виде ионов Cu+) и частично кобальта диффундируют. При этом кубический твердый раствор «обедняется», а тетрагональный «обогащается» медью. Явление подобного рода может быть связано с дополнительными кинетическими затруднениями, вызванными эффектом Яна-Теллера: требуется дополнительное энергетическое воздействие для снятия искажения кристаллической решетки. Протеканию такого процесса должно способствовать «предпочтение» катионами А- или В-позиций в структуре шпинели, связанной с ярко выраженной тенденцией катионов Cr3+ к размещению в В-узлах решетки. Конкуренцию в этом им составляют катионы Ni2+. Из присутствующих в смеси исходных веществ оксидов, у Co2+ наибольшая «склонность» к размещению в А-узлах структуры шпинели. Таким образом, в случае формирования хромита кобальта, создаются благоприятные энергетические условия образования соединения с предпочтительным размещением катионов по тетра- и окта-узлам кристаллической решетки, что должно способствовать формированию наиболее устойчивой структуры.
При формировании твердого раствора, кристаллизующегося в структуре тетрагональной шпинели, механизм может быть представлен следующим образом. Образуется хромит никеля, легированный кобальтом и медью. При этом можно полагать, что катионы хрома занимают октаэдрические, а двухвалентные катионы – тетраэдрические узлы кристаллической решетки. При повышенной температуре структура образовавшегося продукта реакции близка к кубической. При понижении температуры вследствие проявления эффекта Яна-Теллера будет наблюдаться переход к тетрагонально-искаженной структуре. Искажение решетки обусловлено присутствием катионов Ni2+ и Cu2+ в тетра-позициях. При повторных циклах термообработки структура формирующегося материала периодически изменяется от тетрагонально-искаженной к кубической и наоборот. В точке фазового перехода активно протекают диффузионные процессы, которые существенно затрудняются при понижении температуры (в тетрагональной фазе) вследствие искажения решетки. В этой связи формирование подобной структуры может быть более длительным по времени процессом.
Образующийся материал имеет высокую степень кристалличности. Средний размер зерен кристаллов, рассчитанный по формуле Шеррера, составляет 8 нм. Площадь поверхности, измеренная методом ВЕТ, составляет 0,5 м2/г.
Изучение каталитической активности синтезированных материалов проводили на примере реакции окислительной деструкции метилового оранжевого в присутствии пероксида водорода. В ходе проведенного исследования установлено, что твердые растворы системы 0,6 NiCr2O4 – 0,2 CoCr2O4 – 0,2 CuCr2O4 проявляют высокую каталитическую активность в реакции Фентона. Временная зависимость количества метилового оранжевого, подвергшегося каталитической деструкции, приведена на рис. 2. Данная зависимость имеет вид S-образной кривой. Невысокая скорость реакции в начальный период может быть связана с высокой кристалличностью материала и, вследствие этого, малым количеством активных центров.
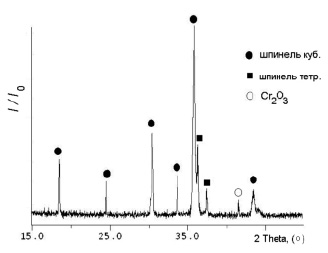
Рис. 1. Рентгенограмма образца состава 0,6 NiCr2O4 – 0,2 CoCr2O4 – 0,2 CuCr2O4
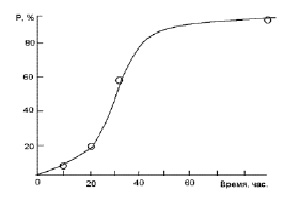
Рис. 2. Зависимость степени разложения метилового оранжевого от времени протекания реакции
Полученные результаты по высокой степени деструкции органического вещества могут быть полезны для разработки материалов для очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.
Выводы
Изучен процесс формирования структуры шпинели в системе состава 0,6NiCr2O4 – 0,2CoCr2O4 – 0,2CuCr2O4. Отмечено формирование двух твердых растворов – на основе хромита кобальта (II) и на основе хромита никеля (II). Высказано предположение о влиянии эффекта Яна-Теллера и энергетического фактора стабилизации катионов в узлах кристаллической решетки на скорость реакций шпинелеобразования. Установлена высокая каталитическая активность синтезированных материалов в процессе окислительной деструкции метилового оранжевого в присутствии пероксида водорода, что может быть полезным для разработки материалов для очистки сточных вод промышленных предприятий, использующих в производственных циклах органические красители.
Библиографическая ссылка
Шабельская Н.П., Власенко А.И., Постников А.А., Сулима С.И., Зеленская Е.А., Ульянов А.К., Сулима Е.В., Волошина Е.Н. КАТАЛИТИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ РАСТВОРОВ В СЛОЖНОЙ СИСТЕМЕ NiO – CoO – CuO – Cr2O3 // Современные наукоемкие технологии. 2015. № 8. С. 58-61;URL: https://top-technologies.ru/ru/article/view?id=35100 (дата обращения: 05.03.2026).



