В растениях рода Ferula среди кумаринов с моноциклическим сесквитерпеновым заместителем обнаружены гальбановая и каратавиковая кислоты, а так же метиловый эфир гальбановой кислоты. Эти кислоты обладают значительной бактереостатической активностью по отношению к граммположительным и граммотрицательным бактериям, но нераствримы в воде, что ограничивает их практическое использование [1, 2]. Поэтому представляло интерес получить водорастворимые поверхностно-активные производные растительных кислот с углеводами с целью изучения их свойств и биологической активности. Модификации природных кислот с углеводами в виде сложных эфиров позволяют увеличить их гидрофильность, значительно уменьшить токсичность, обеспечить активный транспорт вещества, сохранить, усилить или даже изменить их физиологическую активность [3].
В настоящей статье проводятся результаты синтеза диэфировкаратавиковой и гальбановой кислот с сахарозой реакцией переэтерификации их метиловых эфиров с сахарозой двумя способами. По первому способу – мольное соотношение метилового эфира соответствующих кислот и сахарозы 2:1 и по второму способу – мольное соотношение моно- и метиловый эфиров соответствующих кислот1:1. Рассматривается также синтез смешанных 6,6/-О- диэфировкумариновых и фенолкарбоной (салициловой) кислот с сахарозой реакцией между междумоноэфиром соответствующей кумариновой кислоты и метилсалицилатом в присутствии К2СО3.
По первому способу выход полученныхдиэфиров составлял не более 10 %. А по второму способу выход 6,6/-О-диэфиров удалось увеличить до 20-23 %.
Продукты реакции (1-4) выделяли колоночной хроматографией на силикагеле.
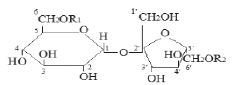
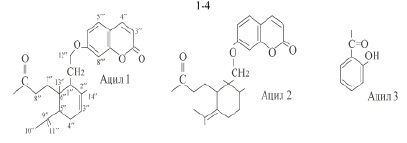
|
1. R1 = R2 = Ацил 1 |
3. R1 = Ацил 1, R2 = Ацил 3 |
|
2. R1 = R2 = Ацил 2 |
4. R1 = Ацил 2, R2 = Ацил 3 |
В ИК-спектрах диэфиров (1-4) валентные колебания С=С связей ароматического кольца находятся в области 1608-1616, 1504-1512 см-1, колебания СО-сложноэфирной группы и СО-α-пирона в области 1714-1736 см-1, в соединениях (3,4) проявляется колебание СО сложноэфирной группы салициловой кислоты в области 1690 см-1. В ИК- спектрах соединений (1-4) присутствуют также полосы поглощения в области 3100-3600 см-1, характерные для ассоциированных ОН-групп.
В ПМР-спектрах диэфиров (1-4) имеется группа сигналов СН-, СН2- групп сахарозной части молекулы при 3,5-5,1 м.д., сигнал аномерного протона глюкозы в области 5,2-5,34 м.д., сигналы протонов ароматического кольца в области 6,75-7,85 м.д.
Положение ацильных остатков в диэфирах (1-4) определяли на основании данных ЯМР 13С-спектроскопии.
В таблице приведены значения химических сдвигов 13С для углеводной части соединений (1-4) и их разности для соответствующих атомов углерода диэфиров относительно сахарозы.
Химические сдвиги атомов углерода углеводной части соединений 1-4 (δ, м.д., CD3OD, 0-ТМС)
|
Атом углерода |
Сахароза |
1(Δ) |
2(Δ) |
3(Δ) |
4(Δ) |
|
1 |
91.82 |
92.26(+0.44) |
92.15(+0.33) |
92.22(+0.40 |
92.18(+0.36) |
|
2 |
71.28 |
71.54(+0.26) |
71.44(+0.16) |
71.50(+0.22) |
71.42(+0.14) |
|
3 |
72.32 |
72.71 (+0.39) |
72.58(+0.26) |
72.46(+0.14) |
72.43(+0.11) |
|
4 |
69.88 |
70.33(+0.45) |
70.26+0.38) |
70.23(+0.35) |
70.20(+0.32) |
|
5 |
72.76 |
70.25(-2.51) |
70.33(-2.33) |
70.43(-2.33) |
70.38(-2.38 ) |
|
6 |
60.34 |
63.73(+3.39) |
63.54(+3.20) |
63.50(+3.16) |
63.42(+3.08) |
|
1/ |
62.08 |
62.54(+0.46) |
62.13(+0.35) |
62.50(+0.12) |
62.38(+0.30) |
|
2/ |
103.73 |
104.15(+0.42) |
104.24(+0.51) |
103.92(+0.19) |
104.10(+0.37) |
|
3/ |
77.06 |
77.54(+0.48) |
77.46(+0.40) |
77.56(+0.50) |
77.36(+0.30) |
|
4/ |
74.05 |
74.26(+0.21) |
74.35(+0.30) |
74.25(+0.20) |
74.36(+0.31) |
|
5/ |
81.34 |
79.23(-2.11) |
79.03(-2.31) |
79.55(-1.79) |
79.65(-1.69) |
|
6/ |
61.83 |
65.62(+3.79) |
65.84(+4.01) |
65.80(+3.97) |
65.71(+3.88) |
Ацилирование по первичным гидроксильным группам глюкозы (С-6) и фруктозы (С-6›) подтверждается тем, что сигналы атомов углерода (С-6 и С-6′), находящиеся в α-положении по отношению к сложноэфирным группам, сдвигаются в слабое поле на 3-4 м.д., а в β-положении (С-5, С-5›) претерпевают диамагнитный сдвиг на 1,7-2,5 м.д. по сравнению со значениями химических сдвигов соответствующих атомов углерода незамещенной сахарозы. Химический сдвиг атома углерода другой первичной гидроксильной группы фруктозной части молекулы сахарозы (С-1›) изменяется незначительно (∆δ=±0,5 м.д.). Химические сдвиги 13С ациловкумариновых и салициловой кислот находятся в соответствии с химическими сдвигами атомов углерода исходных метиловых эфиров этих кислот.
Экспериментальная часть
ИК-спектры записали на приборе UR-20 (таблетки KBr), ЯМР1Н и 13С-спектры – на приборе Mercury-300 cрабочей частатой 300 и 75 мГц соответственно, с ТМС в качестве внутреннего эталона в дейтерированном метаноле.
Ход реакций контралировали методом ТСХ на пластинках SilufolUV-254. Очистку и разделение веществ поводили колоночной хроматографией на силикагеле.
Синтез диэфировкумариновых кислот с сахарозой (1,2)
1 Способ
1,8 г (0,005 моль) сахарозы растворяли в 30 мл перегнанного ДМФА, затем добавляли 4,3 г (0,01 моль) метилового эфира соответствующей кислоты, растворенного в 30 мл ДМФА и 0,15 г (0,001 моль) К2СО3 в качестве катализатора. Реакцию проводили при 90-100оС в вакууме (100-120 мм.рт.ст.) в атмосфере аргона в течение 11-13 часов. Растворитель отгоняли в вакууме и продукты реакций сушили при 65-70оС и давлении 5-10 мм.рт.ст. Диэфирыкаратавиковой и гальбановой (2.64, 2.65) кислот выделяли колоночной хроматографией на силикагеле L (0,04-0,1 мм) элюируя смесью растворителей, хлороформ-метанол в соотношении 9:1.
Получили 1-вещество – 6,6/-О-диэфиркаратавиковой кислоты и сахарозы: 0.58 г., т.пл. 116-118 °С, Rf 0,56 (хлороформ-метанол, 4:1). Найдено, %: С-65.73, Н-6.67, С60Н74О19. Вычислено, %: С-65.57, Н-6,74;
2-Вещество – 6,6/-О-диэфиргальбановой кислоты и сахарозы: 0.52 г. (9 %), т.пл. 123-1250С, Rf 0,62 (хлороформ-метанол, 4:1). Найдено, %: С-65.44, Н-7.12, С60Н78О19. Вычислено, %: С-65.33, Н-7.08;
2 Способ
К 2 г (0,0028 моль) моноэфиракаратавиковой (или гальбановой) кислоты и сахарозы, растворенного в 30 мл ДМФА, добавляли 1,14 г (0,0028 моль) метилового эфира соответствующей кислоты и 0,04 г (0,00029 моль) К2СО3. Реакцию осуществляли при 95-105 оС в вакууме (100-120 мм.рт.ст.) в атмосфере аргона в течение 10-12 часов. Растворитель отгоняли и продукты реакций сушили при температуре 60-70 оС в вакууме (5-10 мм.рт.ст.). Диэфирыкаратавиковой и гальбановой кислот выделяли аналогично, как и по 1-способу.
Получили: 0.7 г. (23 %) 1-вещества и 0.62 г. (20.3 %) 2-вещества.
Синтез разнокислотныхдиэфировкумариновых и салициловой кислот с сахарозой (3,4)
2 г (0,0028 моль) моноэфиракаратавиковой (или гальбановой) кислоты и сахарозы растворяли в 50 мл ДМФА, добавляли 0,42 г (0,0028 моль) метилсалицилата и 0,04 г (0,00029 моль) К2СО3, в качестве катализатора. Реакцию проводили при температуре 95-100оС в вакууме (100-120 мм.рт.ст.) в течение 8 часов. ДМФА удаляли в вакууме и продукты реакций высушивали при температуре 60-65оС (5-10 мм.рт.ст.). Смешанные диэфиры (2.66, 2.67) выделяли колоночной хроматографией на силикагеле L (0,04-0,1 мм) элюируя смесью растворителей хлороформ-метанол 9:1.
Получили 3- вещество – 6,6/-О-диэфиркаратавиковой и салициловой кислот с сахарозой: 0.61 г. (26 %), т.пл. 106-107 °С, Rf 0,46 (хлороформ-метанол, 4:1). Найдено, %: С-61.26, Н-6.22, С43Н52О17. Вычислено, %: С-61.43, Н-6,19;
4-Вещество – 6,6/-О-диэфиргальбановой и салициловой кислот с сахарозой: 0.52 г. (26 %), т.пл. 108-110 °С, Rf 0,42 (хлороформ-метанол, 4:1). Найдено, %: С-61.14, Н-6.46, С43Н54О17. Вычислено, %: С-61.28, Н-6.40;
Библиографическая ссылка
Алдабергенова М.Т., Сапарбекова И.С. СИНТЕЗ ДИЭФИРОВ ПРИРОДНЫХ КУМАРИНОВЫХ И СМЕШАННЫХ ДИЭФИРОВ ФЕНОЛКАРБОНОВОЙ И КУМАРИНОВОЙ КИСЛОТ С САХАРОЗОЙ // Современные наукоемкие технологии. 2014. № 9. С. 56-58;URL: https://top-technologies.ru/ru/article/view?id=34705 (дата обращения: 01.03.2026).



