Азот был открыт почти одновременно несколькими исследователями. Британский химик и физик Генри Кавендиш получил азот из воздуха (1772 г), пропуская последний через раскаленный уголь, а затем через раствор щелочи для поглощения углекислоты. Кавендиш не дал специального названия новому газу, упоминая о нем как о мефитическом воздухе. В это же время другой британский исследователь Джозеф Пристли проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот. Он считал, что процесс был противоположным – не кислород удалялся из газовой смеси, а наоборот, в результате обжига, воздух насыщался флогистоном. Оставшийся воздух (азот) ученый назвал насыщенным флогистоном. Хотя Пристли, смог выделить азот, он не понял сути своего открытия, поэтому и не считается первооткрывателем азота. Официально открытие азота обычно приписывается шотландскому химику и ботанику Даниэлю Резерфорду, опубликовавшему в 1772 г. диссертацию «О фиксируемом воздухе, называемом иначе удушливым», где впервые описаны некоторые химические свойства азота.
Азот в соединении с кислородом образует ряд бинарных соединений: оксид диазота – N2O, оксид азота – NO, триоксид диазота – N2O3, диоксид азота – NO2, пентаоксид диазота – N2O5. Недавно были обнаружены димер диоксида азота (NO2)2 и четыре малостабильных соединения: нитрозилазид NON3, нитрилазид NO2N3, тринитрамид N(NO2)3 и нитратный радикал NO3.
Рассмотрим оксид азота (II) (диоксид азота). NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами ( фосфор , сера и углерод горят в нём). Применяется при производстве серной и азотной кислот , в качестве окислителя в жидком ракетном топливе и смесевых взрывчатых веществах. При смешении газа, содержащего NO с кислородом, максимальная скорость окисления соответствует концентрации кислорода в смеси 33,3 % [1]. Определим концентрацию кислорода, обеспечивающую максимальную скорость реакции, при смешивании газа с воздухом. Скорость реакции 2NO + O2 = 2NO2 выражается формулой V= k∙x2y, где x, y – концентрации NO и O2 соответственно. Обозначим за 1 объем газа, содержащего оксид азота. Добавим к данному газу n объемов воздуха. Пусть a – объемная доля NO в исходном газе, тогда концентрация NO в полученной смеси равна 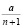 . Так как в воздухе содержится 20,9 % кислорода, то его концентрация в смеси будет равна
. Так как в воздухе содержится 20,9 % кислорода, то его концентрация в смеси будет равна 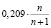 . В этом случае скорость реакции окисления выражается формулой
. В этом случае скорость реакции окисления выражается формулой
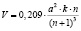 .
.
Найдем максимум составленной функции. При вычислении производной по переменной n получим:
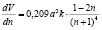 .
.
Следовательно, функция V имеет единственную неотрицательную критическую точку n=1/2. Для определения характера экстремума найдем вторую производную функции V в точке n=1/2:
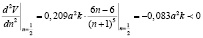 .
.
Так как вторая производная функции в критической точке отрицательна, то n=1/2 – точка максимума данной функции.
Следовательно, для обеспечения максимальной скорости окисления NO объем газа, содержащего оксид азота, должен в два раза превышать объем добавляемого воздуха. При этом концентрация кислорода в смеси будет равна
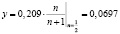 , т.е. 6,97 %.
, т.е. 6,97 %.
Библиографическая ссылка
Тумашик И.В., Антипина С.Г. МАКСИМАЛЬНАЯ СКОРОСТЬ ОКИСЛЕНИЯ АЗОТА ПРИ СМЕШЕНИИ ГАЗА С ВОЗДУХОМ // Современные наукоемкие технологии. 2014. № 5-2. С. 230-230;URL: https://top-technologies.ru/ru/article/view?id=34095 (дата обращения: 05.03.2026).



