Литературные данные по биологической активности декагидрохинолиновых алкалоидов, а также накопленный к настоящему времени опыт по их синтезу открывают перспективы для создания новых эффективных лекарственных препаратов. Сочетание в одной молекуле декагидрохинолинового каркаса и диметоксифенилэтильной группы в синтезированных соединениях делает их близкими структурными аналогами природных алкалоидов.
Подобный подход использовали при получении 1-[2-(3′,4′-диметоксифенил)этил]-2-фенилдекагидрохинолин-4-она (3). Синтез данного аминокетона осуществляли гетероциклизацией стирил-1-циклогексенилкетона (1) с 2-(3′,4′-диметоксифенил)этиламином (гомовератриламином – близким аналогом природного алкалоида мессина) (2) в абсолютном этаноле. В результате реакции с 67 %-м выходом образуется смесь двух стереоизомеров (3 γ, β), со значительным преобладанием изомера 3 γ.
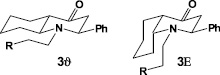
Полученная смесь пространственных изомеров 3 γ, β разделена на индивидуальные формы дробной кристаллизацией из гексана. В итоге изолировано 74,3 % (от общего количества смеси) изомера 3 γ и лишь 2 % – 3 β. Строение индивидуальных стереоизомеров 3 γ, β установлено с помощью ИК-, ЯМР 1Н спектроскопии и масс-спектрометрии. Им приписаны следующие конфигурации:
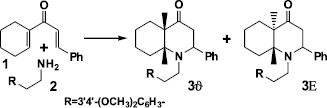
Гетероциклизация диенона 1 с гомовератриламином (2), в отличие от аммиака [15, 16], приводит к образованию двух стереоизомеров 3 γ и 3 β с резким преобладанием изомера 3 γ с экваториальной ориентацией фенила при С3 и транс-сочленением циклов. Выделенный в незначительном количестве второй изомер 3 β является представителем цис-ряда.
Библиографическая ссылка
Жилкибаев О.Т. СИНТЕЗ И СТЕРЕОИЗОМЕРИЯ 1-[2-(3’,4’-ДИМЕТОКСИФЕНИЛ)ЭТИЛ]-2-ФЕНИЛДЕКАГИДРОХИНОЛИН-4-ОНА // Современные наукоемкие технологии. 2013. № 4. С. 65-66;URL: https://top-technologies.ru/ru/article/view?id=31607 (дата обращения: 05.03.2026).



