Эффективное использование сырья – это одно из важнейших направлений развития перерабатывающих отраслей АПК. При этом необходимо повышать безотходность технологий, учитывать требования снижения энергоемкости и защиты окружающей среды. Создание комплексных технологий конверсии растительного сырья и отходов его переработки в целевые продукты, в том числе, применительно к распространенному в России сырью [1].
Наиболее рациональным направлением выбора сырьевых источников для получения функциональных продуктов питания являются вторичные продукты, образующиеся при переработке растительного сырья в сельскохозяйственном производстве, в сахарной, пивоваренной, масложировой, молочной промышленности и т.д. Эти отходы богаты ценными функциональными компонентами: пищевыми волокнами, пектином, витаминами, натуральными растительными жирами, минеральными веществами [2, 3].
В настоящее время современными способами для переработки растительного сырья и получение пищевых веществ является биотехнологические способы, основанные на действии ферментов микробного происхождении [4].
Целью данного исследования явилось получение биологически важных веществ из вторичных продуктов переработки растительного сырья и изучение критериев качества и безопасности функциональных продуктов.
Исследования проводились в научно-образовательном центре Кемеровского технологического института пищевой промышленности, г. Кемерово.
В работе использовались дрожжи Saccharomyces cerevisiae, посевной материал которых выращивали на полученных гидролизатах при рН 5,0, температуре 30 °С при постоянном перемешивании реакционной среды со скоростью 500 об./мин и аэрации до начала стационарной фазы.
Определение сырого протеина в сырье определяли экспресс-анализаторе азота Rapid N Сube, сырой клетчптки – с помощью системы Fibertek 1070, редуцирующих веществ – фотометрическим методом по методике Вишнякова. Токсичность оценивали с помощью тест-организмов Tetrachimena pyriformis на стандартной питательной среде по ГОСТ 28178-89.
Объектами настоящих исследований являлись такие растительные вторичные сырьевые ресурсы, как свекловичный жом, тыквенное сырье и солома гречихи. Выбор данных видов сырья обусловлен широким распространением, а также наличием широкого спектра эффективных биологически активных веществ (табл. 1).
Таблица 1
Физико-химический состав вторичных сырьевых ресурсов
|
Показатель |
Содержание в сырье, % |
||
|
Солома гречихи |
Свекловичный жом |
Тыквенное сырье |
|
|
Сырой протеин |
2,54 |
4,5 |
6,4 |
|
Клетчатка |
45,78 |
3,7 |
4,2 |
|
Жир |
1,16 |
0,8 |
2,94 |
|
Зола |
2,19 |
0,64 |
2,63 |
Из табл. 1 следует целесообразность использования для получения функциональных продуктов питания соломы гречихи, которая в составе практически не имеет витаминов, но содержит пищевые волокна (целлюлоза, гемицеллюлоза), выводящие из организма вредные вещества.
Клетчатка соломы гречихи подвергается микробной биоконверсии в углеводно-белковый кормовой продукт, содержание сырого протеина в котором составляет 18,6 %, а клетчатки 26,4 %.
Свекловичный жом и тыквенное сырье богаты биологически активными веществами, но калорийность этих сырьевых источников низкая (содержание сырого протеина и сырой клетчатки составляет 4,5 и 6,4 %; 3,7 и 4,2 %, соответственно. Свекловичный жом характеризуется наличием пектиновых веществ (6,43 %), способных выводить из организма радионуклиды, улучшать всасывательную функцию толстой кишки, обладающих бактерицидным действием в отношении патогенной микрофлоры и содержащих витамин С.
Тыквенное сырье является источником витамина С, который обладает антиоксидантными, иммуностимулирующими свойствами и содержит пектиновые вещества.
Проведенный анализ подтверждает возможность использования в качестве биологически активных компонентов свекловичного жома, соломы гречихи и тыквенного сырья.
Обогащение соломы гречихи функциональными компонентами проводили на стадии ферментативного гидролиза экспериментальных субстратов в соотношении 1:1 – солома гречихи и свекловичный жом, солома гречихи и тыквенное сырье.
Ферментативный гидролиз 10 %-х водных суспензий экспериментальных субстратов проводили 0,5 % раствором целовиридина Г20Х с использованием дополнительной механической обработки и внесением этой же дозы фермента в реакционную смесь через 2 часа при рН 5,0, температуре 50 °С при постоянном перемешивании реакционной среды со скоростью 150–200 об./мин. Эффективность ферментативного гидролиза представлена в табл. 2.
Таблица 2
Эффективность ферментативного гидролиза 10 %-х водных суспензий экспериментальных субстратов
|
Солома гречихи + свекловичный жом |
Солома гречихи + тыквенное сырье |
||
|
Массовая доля редуцирующих веществ, % |
Глубина гидролиза, % |
Массовая доля редуцирующих веществ, % |
Глубина гидролиза, % |
|
14,15 |
92,4 |
18,2 |
94,3 |
Содержание редуцирующих веществ в экспериментальных субстратах 14,15 и 18,20 %, соответственно, позволяет использовать эти гидролизаты для инокуляции дрожжей и получения функциональных продуктов питания.
Обогащение микробным протеином проводили культивированием дрожжей Saccharomyces cerevisiae на полученных гидролизатах при рН 5,0, температуре 30 °С при постоянном перемешивании реакционной среды со скоростью 500 об./мин и аэрации до начала стационарной фазы.
Показатели гетерофазного глубинного культивирования дрожжей на ферментативных гидролизатах представлены в табл. 3.
Были получены продукты с содержанием сырого протеина 24,0 и 30,0 %, клетчатки – 25,3 и 33,3 %. Сухой продукт из соломы гречихи и свекловичного жома содержит 7,4 %, витамина С 21,1 мг %, а продукт из соломы гречихи и тыквенного сырья – 3,0 % пектиновых веществ и 33,9 мг % витамина С.
Оценку токсичности полученных функциональных продуктов проводили через 1, 24, 72 ч. По морфологическому состоянию Tetrachimena pyriformis. Полученные данные представлены в табл. 4.
Методом биотестирования установлена токсикологическая безопасность полученных функциональных продуктов питания, о чем свидетельствует интенсивное накопление численности и активности инфузорий в течение 72 часов экспонирования.
Таблица 3
Показатели процесса гетерофазного культивирования дрожжей на экспериментальных ферментативных гидролизатах
|
Показатель |
Солома гречихи + свекловичный жом |
Соломагречихи + тыквенное сырье |
|
Концентрация редуцирующих веществ (нач/кон), г/л |
15,42/1,74 |
20,02/1,32 |
|
Потребление редуцирующих веществ, % |
93,03 |
98,07 |
|
Содержание в сухом продукте |
||
|
Сырой протеин, % |
24,0 |
30,0 |
|
Клетчатка, % |
25,3 |
33,3 |
|
Пектиновые вещества, % |
7,4 |
3,0 |
|
Витамин С, мг % |
21,1 |
33,9 |
Таблица 4
Оценка токсичности полученных функциональных продуктов
|
Продукт |
Время экспонирования |
||
|
1 час |
24 час |
72 час |
|
|
Солома гречихи + свекловичный жом |
Живые, морфологических изменений нет |
Живые, без изменений |
Живые, активные, увеличение численности |
|
Солома гречихи + тыквенное сырье |
|||
Распространенными отходами растительного происхождения являются пивная дробина и ржаное сусло. Физико-химический состав пивной дробины представлен в табл. 5.
Для микробиологического синтеза лизина использовали мутантный штамм Brevibacterium sp. В качестве основного источника углерода и энергии штамм ассимилирует, в основном, моно- и диуглеводы. Питательную среду для культивирования Brevibacterium sp.- продуцента лизина готовили на отходах пивоваренного производства – пивной дробины.
Таблица 5
Химический состав пивной дробины (50 % несоложеной ржи + 48 % ячменного солода + 2 % карамельного солода)
|
Химический состав, % |
Значение показателей |
|
Массовая доля растворимых с сухих веществ |
7,20 |
|
Свободные сахара |
0,23 |
|
Декстрины |
0,72 |
|
Массовая доля редуцирующих веществ (гидролиз 60 % H2 SO4) |
4,47 |
|
Гексозы |
1,76 |
|
Аминный азот, мг/100 см3 |
82,0 |
|
Белок |
0,28 |
|
Крахмал |
26,6 |
Богатый состав такой среды дает возможность вести процесс биосинтеза более экономично, снизить расход дополнительных питательных веществ, необходимых для продуцентов лизина. Для конверсии крахмала, глюканов и белковых веществ использовали ферменты микробного происхождения: бактериальные a-амилазы и глюкоамилазы, целлюлазы, ксиланазы, b-глюканазы, лейцинаминопептидазу и карбоксипептидазу совместно с протеиназами соответственно (рисунок).
Известно, что бактериальная a-амилаза обладает высокой способностью к декстринизации крахмала и в меньшей степени – к образованию мальтозы. Декстринизация крахмала питательной среды под действием только одной α-амилазы обеспечивала накопление 48 % редуцирующих углеводов и синтез 47 % лизина от максимального уровня. В дальнейшем гидролиз субстрата осуществляли совместно a-амилазой и глюкоамилазой, так как среди продуктов гидролиза крахмала глюкоамилазой преобладает глюкоза, которая легко усваивается бактериями. Поэтому введение этого фермента позволило увеличить концентрацию редуцирующих веществ в среде на 27 % и повысить эффективность биоконверсии углевода сырья в целевой продукт.
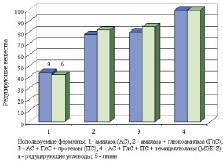
Влияние ферментов на накопление редуцирующих веществ и синтез лизина
Совместное осахаривающее действие α-амилазы и глюкоамилазы с образованием глюкозы позволило повысить выход лизина на 31 %. Введение протеаз способствовало накоплению в среде аминокислот в свободной форме и увеличению содержания легкоусвояемого аминного азота, что обеспечивало повышение степени конверсии углеводов в лизин. Максимальный выход лизина был достигнут при использовании комплекса гидролитических ферментов – МЭК-2. Использование обработанного ферментами пивного сусла, как добавки к питательной среде, позволило снизить количество кукурузного экстракта, вносимого в питательную среду, как ростового фактора (табл. 6).
Таблица 6
Эффективность конверсии пивной дробины в качестве источников углеводов питательной среды в лизин
|
Питательная среда |
Содержание аминного азота, мг/100 мл |
Потребление углеводы, г/100 мл |
Лизин, г/л |
Процент конверсии |
||
|
Обработка ферментами пивной дробины |
Дробина/вода/сусло, % |
Экстракт, % |
||||
|
АС + ГлС + ПС + гемицеллюлазы (ФК-4) |
40/60/0 |
4,0 |
68 |
2,8 |
8,2 |
29,3 |
|
40/40/20 |
0,0 1,0 2,0 4,0 |
28 39 57 110 |
4,1 5,2 6,3 6,5 |
11,0 16,5 20,7 21,7 |
26,8 31,7 32,9 33,3 |
|
|
40/20/40 |
0,0 1,0 2,0 4,0 |
42 52 89 127 |
6,9 7,8 7,9 7,9 |
22,8 28,8 29,2 29,3 |
28,5 36,9 37,0 37,1 |
|
Таким образом, повышению эффективности конверсии углеводов питательной среды, конструируемой на основе полупродуктов и отходов пивоваренного производства, способствует не только повышение накопления в среде усвояемых углеводов, но и свободных аминокислот. Введение пивного сусла в количестве 20–40 % на фоне дробины, обработанной гидролазами, обеспечивало увеличение конверсии в лизин в 2,6–3,6 раза соответственно. Использование протеолитических ферментов позволило снизить в 4 раза расход ростового фактора – кукурузного экстракта, оптимальный уровень которого составил 1,0 %.
На основании проведенных исследований были получение биологически важных веществ из вторичных продуктов переработки растительного сырья и изучение критериев качества и безопасности функциональных продуктов.
Работа выполнена в рамках аналитической ведомственной целевой программы «Развитие научного потенциала высшей школы».
Библиографическая ссылка
Остроумов Л.А., Бабич О.О., Милентьева И.С. ИЗУЧЕНИЕ КРИТЕРИЕВ КАЧЕСТВА И БЕЗОПАСНОСТИ ФУНКЦИОНАЛЬНЫХ ПРОДУКТОВ ПИТАНИЯ, ПОЛУЧЕННЫХ ИЗ ВТОРИЧНЫХ ПРОДУКТОВ ПЕРЕРАБОТКИ РАСТИТЕЛЬНОГО СЫРЬЯ // Современные наукоемкие технологии. 2012. № 12. С. 24-27;URL: https://top-technologies.ru/ru/article/view?id=31123 (дата обращения: 03.02.2026).



